
【题目】氢气是未来最理想的能源之一,科学家最近研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用使海水分解得到氢气的新技术:2H2O![]() 2H2↑+O2↑。制得的氢气可用于燃料电池。试回答下列问题:
2H2↑+O2↑。制得的氢气可用于燃料电池。试回答下列问题:
(1)海水分解生成的氢气用于燃料电池时,实现____能转变为____能。水分解时,断裂的化学键为____键,(填极性共价,非极性共价或离子)分解海水的反应属于_____反应(填“放热”或“吸热”)。
(2)某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应分别为:A极:2H2+2O2--4e-===2H2O;B极:O2+4e-===2O2-,则A极是电池的____极;电子从该极_____(填“流入”或“流出”)。电流从该电极_____(填“流入”或“流出”)
(3)有人以化学反应:2Zn+O2+4H+===2Zn2++2H2O为基础设计出一种原电池,移入人体内作为心脏起搏器的能源,它们靠人体内血液中溶有一定浓度的O2、H+、Zn2+进行工作。则原电池的负极材料是____,正极上发生反应的电极反应式为____。
【答案】化学 电 极性共价 吸热 负 流出 流入 Zn O2+4H++4e-=2H2O
【解析】
(1)原电池是将化学能转化为电能的装置,非金属元素之间形成的化学键大多是共价键,物质的分解反应是吸热反应;
(2)中性或弱酸性条件下,钢铁发生吸氧腐蚀,负极上铁失电子发生氧化反应;铁与水和氧气同时接触时容易生锈,因此隔绝水和氧气可以防止铁制品生锈。
(1)海水分解生成的氢气用于燃料电池,燃料电池是将化学能转化为电能的装置,水分解时,断裂的化学键为HO键,属于极性共价键,分解海水的反应属于吸热反应,
故答案为:化学;电;极性共价;吸热;
(2) 由A极的电极反应式2H2+2O2--4e-===2H2O可知,A电极上发生的是氧化反应,所以A极是电池的负极,电子从负极流出,而电流与电子的流向相反,所以流入A极,
故答案为:负;流出;流入;
(3)由总反应2Zn+O2+4H+===2Zn2++2H2O看,电解质溶液为酸性环境,反应中锌被氧化为锌离子,所以原电池的负极材料是锌,正极氧气得电子转化为水,发生反应的电极反应式为O2+4H++4e-=2H2O,
故答案为:Zn;O2+4H++4e-=2H2O。


科目:高中化学 来源: 题型:
【题目】溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物。某同学依据溴乙烷的性质,用如图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究。
实验操作Ⅰ:在试管中加入5 mL 1 mol/L NaOH溶液和5 mL溴乙烷,振荡。
实验操作Ⅱ:将试管如图固定后,水浴加热。

(1)用水浴加热而不直接用酒精灯加热的原因是_________;试管口安装一长导管的作用是________________________。
(2)观察到________________现象时,表明溴乙烷与NaOH溶液已完全反应。
(3)鉴定生成物中乙醇的结构,可用的波谱是_____________________。
(4)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,在你设计的实验方案中,需要检验的是________________,检验的方法是______________________________说明所用的试剂、简单的实验操作及预测产生的实验现象)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为地壳中含量最多的金属元素的固态氧化物,F是红褐色难溶于水的沉淀,A、B、C、D、E、F六种物质中均含同一种元素。
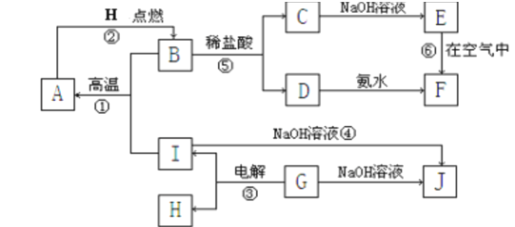
请填写下列空白:
(1)写出下列物质的化学式A_______________;G____________________;
(2)若C→D为化合反应,则此时的化学方程式_______________________________;
(3)写出E→F的化学方程式___________________________________________ ;
(4)写出反应④的离子方程式___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-a kJ·mol-1 在5 L密闭容器中进行,10 s时,水蒸气的物质的量增加了0.60 mol。则下列说法不正确的是( )
4NO(g)+6H2O(g) ΔH=-a kJ·mol-1 在5 L密闭容器中进行,10 s时,水蒸气的物质的量增加了0.60 mol。则下列说法不正确的是( )
A. 10 s内,NH3的平均反应速率为0.008 mol·L-1·s-1
B. 该反应达到平衡时6v正(O2)=5v逆(H2O)
C. 10 s内,反应放出的热量为0.1a kJ
D. 10 s时,H2O的反应速率为0.012 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下向20 mL 0.1 mol/L HA溶液中逐滴加入0.1 mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中不正确的是

A. 由题可知HA为弱酸
B. 滴定终点位于c和d之间
C. 滴定到b点时:n(Na+)+ n(H+)-n(OH-)+ n(HA)=0.002 mol
D. 滴定到d点时:c(OH-)>c(Na+)>c(A-) >c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为迎接G20峰会的到来,浙江加大了对环境治理的力度。其中对含氮化物的处理是一个重要的课题。
Ⅰ.氮氧化物
(1)已知:N2(g)和O2(g)反应生成NO(g)过程中的能量变化情况如下

①2NO(g) ![]() N2(g)+O2(g) △H=_______________
N2(g)+O2(g) △H=_______________
②你认为该反应能否自发,并说明理由____________________________________
(2)科学家利用2NO(g) ![]() N2(g)+O2(g)来消除NO的污染。1molNO在恒温、容积恒定为1L的密闭容器中反应,10min后达到平衡,NO的物质的量为0.4mol。在第15min时,保持温度不变,将容器的体积迅速增大至2L并保持恒容,第25min时到达平衡;第30min时,保持温度和体积不变,向容器中再通入0.2molNO,第50min时达到平衡,请在右图中画出从第15min起到70minNO的物质的量随时间变化的曲线。_________
N2(g)+O2(g)来消除NO的污染。1molNO在恒温、容积恒定为1L的密闭容器中反应,10min后达到平衡,NO的物质的量为0.4mol。在第15min时,保持温度不变,将容器的体积迅速增大至2L并保持恒容,第25min时到达平衡;第30min时,保持温度和体积不变,向容器中再通入0.2molNO,第50min时达到平衡,请在右图中画出从第15min起到70minNO的物质的量随时间变化的曲线。_________

Ⅱ.亚硝酸盐
(1)来源:用氧化性熔融盐处理钢铁表面氧化膜时会产生污染物亚硝酸盐,请写出FeO与NaNO3在加热条件下发生的反应________________________。
(2)电化学处理:用电解法降解NO2其原理如下图所示电源正极为_______(填A或B),阴极反应式为__________________________________ 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅的叙述中不正确的是( )
A.晶体硅的结构与金刚石的结构类似
B.晶体硅其熔点高、硬度大、不溶于水
C.硅是灰黑色、具有金属光泽的固体
D.硅广泛存在于自然界中,天然单质硅叫硅石
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中CO、NOx以及燃煤废气中的SO2都是大气污染物,对它们的治理具有重要意义。
(1)氧化还原法消除NOx的转化如下所示:
NO![]() NO2
NO2![]() N2
N2
①反应Ⅰ为NO+O3===NO2+O2,生成标准状况下11.2 L O2时,转移电子的物质的量是____mol。
②反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,氧化产物与还原产物的质量比为____。
(2)使用“催化转化器”可以减少尾气中的CO和NOx,转化过程中发生反应的化学方程式为CO+NOx―→N2+CO2(未配平),若x=1.5,则化学方程式中CO2和N2的化学计量数之比为____。
(3)吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如图所示(Ce为铈元素)。
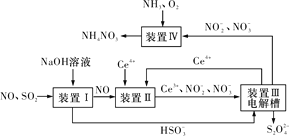
装置Ⅱ中,酸性条件下NO被Ce4+氧化的产物主要是NO3-和NO2-,请写出生成等物质的量的NO3-和NO2-时的离子方程式:____。
(4)装置Ⅲ的作用之一是用质子交换膜电解槽电解使得Ce4+再生,再生时生成的Ce4+在电解槽的____(填“阳极”或“阴极”),同时在另一极生成S2O42-的电极反应式为___。
(5)已知进入装置Ⅳ的溶液中NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,至少需向装置Ⅳ中通入标准状况下的氧气____L(用含a代数式表示,结果保留整数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com