
| A. | 直接排放工业废气 | B. | 改进汽车尾气净化技术 | ||
| C. | 采用焚烧方法处理垃圾 | D. | 过度开采和使用化石燃料 |
分析 为了使“蓝天工程“可持续发展,应减少空气污染,依据常见的空气污染源分析解答.
解答 解:A.直接排放工业废气,导致大量空气污染气体排放,不利于“蓝天工程“可持续发展,故A错误;
B.改进汽车尾气净化技术,能够减少废气的排放,有利于“蓝天工程“可持续发展,故B正确;
C.采用焚烧方法处理垃圾,能够引起大量粉尘、有毒气体的排放,引起空气污染,不利于“蓝天工程“可持续发展,故C错误;
D.过度开采和使用化石燃料,导致大量空气污染气体及粉尘的排放,引起空气污染,不利于“蓝天工程“可持续发展,故D错误;
故选:B.
点评 本题考查了生活中常见的环境污染与治理,有利于培养环境保护意识,题目难度不大,注意积累.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:推断题
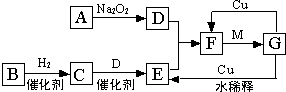 如图是由短周期元素组成的一些单质及其化合物之间的转化关系图(部分产物和反应条件已略去),其中A、B、D在常温下均为无色、无刺激性气味的气体,C是能使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体.
如图是由短周期元素组成的一些单质及其化合物之间的转化关系图(部分产物和反应条件已略去),其中A、B、D在常温下均为无色、无刺激性气味的气体,C是能使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 卤代烃在NaOH的醇溶液中共热均能发生消去反应生成烯烃 | |
| B. | 凡是能发生银镜反应的物质都属于醛类 | |
| C. | 能与FeCl3溶液作用显紫色的有机物一般含有酚羟基 | |
| D. | 酯类水解均能生成含相同碳原子数的羧酸和醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是易导电的银白色金属 | B. | Tl(OH)3是两性氢氧化物 | ||
| C. | Tl3+能形成+3价的化合物 | D. | 单质能与稀硝酸反应生成硝酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸银与氯化钾溶液的反应:Ag++Cl-═AgCl↓ | |
| B. | 硝酸与氢氧化钠溶液的反应:H++OH-═H2O | |
| C. | 碳酸钙与盐酸的反应:CO32-+2H+═CO2↑+H2O | |
| D. | 锌粒与稀硫酸的反应:Zn+2H+═Zn2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 KMnO4是锰的重要化合物,它是一种良好的氧化剂,用来漂白毛、棉和丝,或使油类脱色.其制备方法如下:
KMnO4是锰的重要化合物,它是一种良好的氧化剂,用来漂白毛、棉和丝,或使油类脱色.其制备方法如下: 2KMnO4+2KOH+H2↑.在整个制备流程中可循环利用的物质是氢氧化钾(写名称).
2KMnO4+2KOH+H2↑.在整个制备流程中可循环利用的物质是氢氧化钾(写名称).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
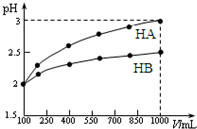 已知100mL pH=2的两种一元酸HA和HB,稀释过程中pH与溶液体积的关系如图所示.
已知100mL pH=2的两种一元酸HA和HB,稀释过程中pH与溶液体积的关系如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com