
将1 mol冰醋酸加入到一定量的蒸馏水中最终得到1 L溶液。下列各项中,表征已达到电离平衡状态的是( )
A.醋酸的浓度达到1 mol·L-1
B.[H+]的浓度达到0.5 mol·L-1
C.[CH3COOH]、[CH3COO-]、[H+]均为0.5 mol·L-1
D.醋酸分子电离成离子的速率和离子重新结合成分子的速率相等
 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
柠檬烯是一种食用香料,其结构简式如图,有关柠檬烯的分析错误的是
A.在一定条件下,1mol柠檬烯可与2molH2完全加成
B.柠檬烯的一氯代物有7种
C.在一定条件下,柠檬烯可发生加成、取代、氧化、还原反应
D.柠檬烯分子中所有碳原子不可能都在同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
有一瓶澄清溶液,其中可能含有NH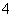 、K+、Na+、Mg2+、Ba2+、Al3+、Fe3+、Cl-、I-、NO
、K+、Na+、Mg2+、Ba2+、Al3+、Fe3+、Cl-、I-、NO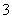 、CO
、CO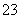 、SO
、SO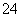 中的几种。取该溶液进行以下实验。
中的几种。取该溶液进行以下实验。
(1)填写表中空白:
| 实验步骤 | 肯定不存在的离子 |
| ①用pH试纸检验,溶液呈强酸性 | |
| ②取出部分溶液,加入少量CCl4及数滴新制的氯水,经振荡、静置后CCl4层呈紫红色 | |
| ③另取部分溶液,向其中加入NaOH溶液,使溶液从酸性逐渐变为碱性,在滴加过程中及滴加完毕后,均无沉淀产生 | |
| ④取③中的部分碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝 | |
| ⑤另取③中的部分碱性溶液,向其中加入Na2CO3溶液,有白色沉淀产生 |
(2)根据以上事实,该溶液中肯定存在的离子是________。
(3)写出实验②、④、⑤中反应的离子方程式:
实验②________________________________________________________________________;
实验④________________________________________________________________________;
实验⑤________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态的三氧化二硼和液态水,放出649.5 kJ热量,其热化学方程式为______________________________________。
又已知:H2O(l)===H2O(g) ΔH=44 kJ·mol-1。则11.2 L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是__________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
在100 mL 0.1 mol·L-1的醋酸溶液中,欲使醋酸的电离程度增大,H+浓度减小,可采用的方法是( )
A.加热
B.加入100 mL 0.1 mol·L-1的醋酸溶液
C.加入少量的0.5 mol·L-1的硫酸
D.加入少量的1 mol·L-1的NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
双氧水(H2O2)和水都是极弱电解质,但H2O2比H2O更显酸性。
(1)若把H2O2看成是二元弱酸,请写出在水中的电离方程式:
________________________________________________________________________
________________________________________________________________________。
(2)鉴于H2O2显弱酸性,它能同强碱作用形成正盐,在一定条件下也可形成酸式盐。请写出H2O2与Ba(OH)2作用形成盐的化学方程式:
________________________________________________________________________
________________________________________________________________________。
(3)水电离生成H3O+和OH-叫作水的自偶电离。同水一样,H2O2也有极微弱的自偶电离,其自偶电离的方程式为_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定浓度的FeCl3溶液中,存在如下水解平衡:Fe3++3H2O Fe(OH)3+3H+,在此溶液中滴入饱和的FeCl3溶液,下列说法中正确的是( )
Fe(OH)3+3H+,在此溶液中滴入饱和的FeCl3溶液,下列说法中正确的是( )
A.水解平衡向正反应方向移动 B.水解平衡向逆反应方向移动
C.溶液中H+浓度不变 D.Fe3+的水解程度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)Fe2(SO4)3水溶液呈________性,原因是(用离子方程式表示) ;
实验室在配制Fe2 (SO4)3溶液时,需要加入________来抑制水解。
(2)泡沫灭火器中装有Al2(SO4)3溶液、NaHCO3溶液及起泡剂。写出使用时发生反应的离子方程式:_____________________________________________________。
| 实验编号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | C | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C、D四种短周期元素在周期表中位置如图所示。
已知:A2+与C原子的电子数相差2。下列推断不正确的是
A.A和D组成的化合物是弱电解质且水溶液呈酸性
B.与A同周期且与C同主族的E元素,其最高价氧化物对应水化物在某些化学反应中常作催化剂。
C.离子半径:C>A>B
D.B与C形成的化合物是冶金工业的一种原料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com