
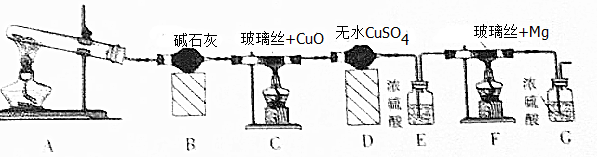
分析 装置A是利用氯化铵和氢氧化钙加热反应制备氨气,装置B为干燥氨气,氨气通入装置C和氧化铜加热反应,NH3可与CuO反应,产物之一是N2,通过装置D中的无水硫酸铜检验生成产物中的水蒸气,通过装置E中的浓硫酸吸收水蒸气,通过装置F和镁反应,氮化镁易与水反应生成Mg(OH)2与NH3.装置G是防止空气中的水蒸气进入装置F,
(1)连接装置后A处加热EG中导气管有气泡冒出,停止加热导气管中有一段水柱上升证明气密性,实验室中是利用氯化铵和氢氧化钙固体加热制备氨气,浓硫酸具有吸水性;
(2)氮化镁易与水反应生成Mg(OH)2与NH3.若未排净装置F中的空气,镁会和空气中氧气、氮气、二氧化碳等发生反应,无水硫酸铜为白色固体遇到水蒸气变化为蓝色,若没有装置G,则可能产生的问题是氮化镁易与水反应生成Mg(OH)2与NH3;
(3)装置C中氨气与灼热氧化铜反应可以生成两种单质,应是氨气还原氧化铜为铜,氨气被还原为氮气,依据原子守恒配平书写化学方程式;
解答 解:(1)检查本套装置气密性的方法是:连接装置后A处微微加热,E、G中导气管有气泡冒出,停止加热导气管中有一段水柱上升,证明装置气密性完好,实验室中是利用氯化铵和氢氧化钙固体在大试管中加热反应制备氨气,浓硫酸具有吸水性,装置E的作用是吸收水蒸气,干燥气体,
故答案为:连接装置后A处微微加热,E、G中导气管有气泡冒出,停止加热导气管中有一段水柱上升,证明装置气密性完好; 氯化铵和氢氧化钙固体;吸收水蒸气,干燥气体;
(2)若未排净装置F中的空气,镁会和空气中氧气、氮气、二氧化碳等发生反应,氮化镁易与水也反应生成Mg(OH)2与NH3.制备得到氮化镁不纯,所以装置有三处需要加热,先加热A生成氨气充满装置后,再加热装置C,最后加热装置F,实验中应放在最后加热的是F,无水硫酸铜为白色固体遇到水蒸气变化为蓝色,证明C中反应有水生成的现象是装置D中无水硫酸铜白色变化为蓝色,装置G是防止空气中的水蒸气进入装置F,若没有装置G,则可能产生的问题是氮化镁易与水反应生成Mg(OH)2与NH3;
故答案为:F;防止装置F中空气未排净,镁和空气中的氧气、氮气、二氧化碳发生反应,氮化镁和水也反应,制得氮化镁不纯;装置D中无水硫酸铜白色变化为蓝色;氮化镁易与水反应生成Mg(OH)2与NH3;
(3)装置C中氨气与灼热氧化铜反应可以生成两种单质,反应的化学方程式为2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O,故答案为:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$ 3Cu+N2+3H2O.
点评 本题考查了物质性质的实验验证、氨气制备、性质验证、反应现象、产物检验等知识点,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:选择题
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。下列反应可制取K2FeO4:2Fe(OH)3+3Cl2+10KOH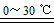 2K2FeO4+6KCl+8H2O。下列有关该反应说法正确的是
2K2FeO4+6KCl+8H2O。下列有关该反应说法正确的是
A.该反应是置换反应 B.钾元素化合价降低
C.Fe(OH)3发生氧化反应 D.Cl2是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| X(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| X(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
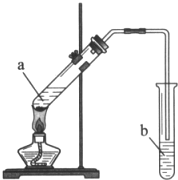 实验室用如图所示装置制备乙酸乙酯.
实验室用如图所示装置制备乙酸乙酯.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如图所示.
乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如图所示.| 乙酸 | 乙醇 | 乙酸乙酯 | 乙醚 | |
| 沸点/℃ | 118 | 78.3 | 77.1 | 34.5 |
| 溶解性 | 易溶于水 | 极易溶于水 | 与乙醚混溶 | 微溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室制取乙酸乙酯的反应装置如图所示,请回答下列问题.
实验室制取乙酸乙酯的反应装置如图所示,请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K=$\frac{{c}^{4}(C){c}^{2}(D)}{{c}^{3}(A){c}^{2}(B)}$ | |
| B. | 增加B,平衡向右移动,B的平衡转化率增大 | |
| C. | 增大该体系的压强,平衡向左移动,化学平衡常数不变 | |
| D. | 此时B的平衡转化率是40% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的速率主要取决于①的快慢 | |
| B. | NOBr2是该反应的催化剂 | |
| C. | 正反应的活化能比逆反应的活化能小a kJ•mol-1 | |
| D. | 增大Br2(g)浓度能增大活化分子百分数,加快反应速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com