解答:
解:①平衡常数K=
; 化学平衡常数k只受温度的影响,在此温度下,当n(CO):n(H
2O)=1:1时,平衡时CO(g)、H
2O(g)、CO
2(g)、H
2(g)的浓度相等,即化学平衡常数K=
=1,在该温度下,向容器中充入1molCO、3mol H
2O、2mol CO
2、1.5molH
2时,浓度商Qc=
=1=K,即为平衡状态,故V
正=V
逆,
故答案为:1;=;
②A、从表中数据可知增加H
2O(g)的量,CO的转化率升高而H
2O(g)的转化率降低,故A正确;
B、物质的转化率=
,而根据反应可知:△n(CO):△n(H
2O)=计量数之比=1:1,故若CO与H
2O(g)的转化率相同时,二者的初始投入量一定相同,B正确;
C、CO和H
2O(g)的转化率之比等于计量数之比,与初始物质的量成反比,故C错误;
D、由计算可知,此温度下反应的平衡常数K=1.设CO与H
2O(g)的初始物质的量浓度分别为1mol/L和4mol/L,达平衡时,CO的△C(CO)为Xmol/L,则根据三段式有:CO(g)+H
2O(g)?CO
2(g)+H
2(g)
初始:1mol/L 4mol/L 0mol/L 0mol/L
△C:Xmol/L Xmol/L Xmol/L Xmol/L
平衡:(1-X)mol/L (4-X)mol/L Xmol/L Xmol/L
根据平衡常数K=
=
=1,解得:X=0.8mo/L,故 CO的转化率=
×100%=80%,故D错误.
故选AB;
③2molM、2mol H
2O,当达平衡时放出a KJ热量,和1molM、1mol H
2O起始量达到相同的平衡状态,平衡常数为1,即转化率为0.5,反应1molM放出akJ的热量,即该反应的△H=-akJ/mol,故答案为:-aKJ/mol.





 ;a与b形成化合物的电子式为:
;a与b形成化合物的电子式为: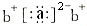 .下列叙述正确的是( )
.下列叙述正确的是( )