
碳单质在工业上有多种用途。例如焦炭可用来制取水煤气、冶炼金属,活性炭可处理大气污染物NO。一定条件下,在2 L密闭容器中加入NO和活性炭(无杂质)反应生成气体A和B。当温度在T1℃时,测得各物质平衡时物质的量如下表:
|
|
活性炭 (mol) |
NO (mol) |
A (mol) |
B (mol) |
|
初始 |
2.030 |
0.100 |
0 |
0 |
|
平衡 |
2.000 |
0.040 |
0.030 |
0.030 |
在T1℃时,达到平衡共耗时2分钟,则NO的平均反应速率为 mol/(L·min);当活性炭消耗0.015mol时,反应的时间 (填“大于”、“小于”或“等于”)1分钟。
在T1℃下反应达到平衡后,下列措施不能改变NO的转化率的是 。
a.增大活性炭的量 b.增大压强 c.升高温度 d.移去部分B
结合上表数据,该反应的平衡常数表达式为 。(生成物A、B用相应的化学式表示)若T1℃时的平衡常数为K1,T2℃时的平衡常数为K2,且K1>K2,能否判断该反应是吸热反应还是放热反应,说明理 。
0.015mol/(L·min),小于(3分)
a b(2分)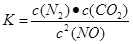 (1分) 不能,无法确定T1、T2的相对高低。(或能,当T1>T2时,反应是吸热反应,当T1<T2时,反应是放热反应(2分)
(1分) 不能,无法确定T1、T2的相对高低。(或能,当T1>T2时,反应是吸热反应,当T1<T2时,反应是放热反应(2分)
【解析】
试题分析:(1)根据表中数据可知,平衡时消耗NO的物质的量是0.100mol-0.040mol=0.060mol,所以其反应速率是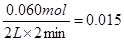 mol/(L·min)。平衡时消耗活性炭的物质的量是2.030mol-2.000mol=0.030mol,由于随着反应的进行。反应物的浓度逐渐减小,因此第一分钟内的反应速率大于第二分钟内的反应速率,所以当活性炭消耗0.015mol时,反应的时间小于1分钟。
mol/(L·min)。平衡时消耗活性炭的物质的量是2.030mol-2.000mol=0.030mol,由于随着反应的进行。反应物的浓度逐渐减小,因此第一分钟内的反应速率大于第二分钟内的反应速率,所以当活性炭消耗0.015mol时,反应的时间小于1分钟。
(2)碳是固体,改变固体的质量,不会改变平衡状态,a不正确;根据表中的数据考查,该反应的方程式应该是C+2NO A+B,即反应前后体积不变,所以改变压强不能改变平衡状态,b不正确;升高温度平衡状态一定变化,移去部分B,则平衡向正反应方向移动,增大反应物的转化率,即选项cd均可以改变反应物的转化率,答案选ab。
A+B,即反应前后体积不变,所以改变压强不能改变平衡状态,b不正确;升高温度平衡状态一定变化,移去部分B,则平衡向正反应方向移动,增大反应物的转化率,即选项cd均可以改变反应物的转化率,答案选ab。
(3)根据原子守恒可知,AB应该是氮气和CO2,又因为化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以该反应的平衡常数表达式是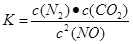 。由于无法确定T1、T2的相对高低,所以不能确定该反应是吸热反应还是放热反应。
。由于无法确定T1、T2的相对高低,所以不能确定该反应是吸热反应还是放热反应。
考点:考查反应速率的计算、外界条件对平衡状态的影响、平衡常数和反应热的判断
点评:该题是中等难度的试题,也是高考中的常见题型。试题在注重对基础知识巩固和训练的图示,侧重对学生解题能力和培养,有利于培养学生的逻辑推理能力和发散思维能力,提高学生的学习效率和学习积极性。


科目:高中化学 来源: 题型:
| 活性炭 (mol) |
NO (mol) |
A (mol) |
B (mol) | |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| 平衡 | 2.000 | 0.040 | 0.030 | 0.030 |
| c(N2)?c(CO2) |
| c2(CO) |
| c(N2)?c(CO2) |
| c2(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:
物质 T/℃n/mol T/℃ |
活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
| 9 |
| 16 |
| 9 |
| 16 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2012-2013学年上海市浦东新区高三下学期二模化学试卷(解析版) 题型:填空题
碳单质在工业上有多种用途。例如焦炭可用来制取水煤气、冶炼金属,活性炭可处理大气污染物NO。
一定条件下,在2 L密闭容器中加入NO和活性炭(无杂质)反应生成气体A和B。当温度在T1℃时,测得各物质平衡时物质的量如下表:
|
|
活性炭 (mol) |
NO (mol) |
A (mol) |
B (mol) |
|
初始 |
2.030 |
0.100 |
0 |
0 |
|
平衡 |
2.000 |
0.040 |
0.030 |
0.030 |
(1)在T1℃时,达到平衡共耗时2分钟,则NO的平均反应速率为 mol/(L·min);当活性炭消耗0.015mol时,反应的时间 (填“大于”、“小于”或“等于”)1分钟。
(2)在T1℃下反应达到平衡后,下列措施不能改变NO的转化率的是 。
a.增大活性炭的量 b.增大压强 c.升高温度 d.移去部分B
(3)结合上表数据,该反应的平衡常数表达式为 。(生成物A、B用相应的化学式表示)若T1℃时的平衡常数为K1,T2℃时的平衡常数为K2,且K1>K2,能否判断该反应是吸热反应还是放热反应,说明理 。
查看答案和解析>>
科目:高中化学 来源:2012年北京市西城区高考化学二模试卷(解析版) 题型:填空题
物质 T/℃n/mol T/℃ | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | ||
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com