
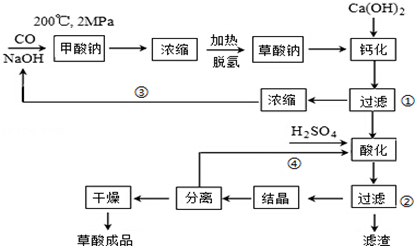
���� ��1�����ݷ�Ӧ�������ͷ�Ӧ����д����Ӧ����ʽ��
��2���������ƺͲ�������Һ��Ӧ�����������ƺͲ���ƣ������������ˮ������ƺ�ϡ���ᷴӦ���ɲ��������ƣ�����������
��3��ѭ�����õ������ܽ��ͳɱ���������Ⱦ��
��4�������ƺ����ᷴӦ���������ƣ��������ǿ��������ʣ�
��5�����Ը��������Һ����ǿ�����ԣ�������������������ɶ�����̼��ͬʱ��������ԭ���ɶ��������ӣ����ݲ���������֮��Ĺ�ϵʽ�����������ʵ������ٸ�������������ʽ�����䴿�ȣ�
��� �⣺��1����������ͼ֪��200�桢2MPa�����£�һ����̼���������Ʒ�Ӧ���ɼ����ƣ���Ӧ����ʽΪ��CO+NaOH$\frac{\underline{\;200��\;}}{2Mpa}$HCOONa�����������£��������������ɲ����ƺ���������Ӧ����ʽΪ��2HCOONa$\stackrel{��}{��}$Na2C2O4+H2����
�ʴ�Ϊ��CO+NaOH$\frac{\underline{\;200��\;}}{2Mpa}$HCOONa��2HCOONa$\stackrel{��}{��}$Na2C2O4+H2����
��2���������ƺͲ�������Һ��Ӧ�����������ƺͲ���ƣ������������ˮ�����Թ��˲����ٵ���Һ������������Һ��������CaC2O4������ƺ�ϡ���ᷴӦ���ɲ��������ƣ������������ò��������У�ϡ������������Թ��˲����ڵ���Һ��H2C2O4��Һ��H2SO4��Һ�������� CaSO4��
�ʴ�Ϊ��CaC2O4 ��H2C2O4��Һ��H2SO4��Һ��
��3���������ƺ����ᶼ���и�ʴ�ԣ�����Ⱦ�������ֱ�ѭ�������������ƺ������ܽ��ͳɱ�����С��Ⱦ��
�ʴ�Ϊ���ֱ�ѭ�������������ƺ������ܽ��ͳɱ�����С��Ⱦ��
��4�������ƺ����ᷴӦ���������ƣ��������ǿ��������ʣ���������Һ�У����Ժ��е�������Ҫ��Na2SO4��
�ʴ�Ϊ��Na2SO4��
��5�����Ը��������Һ����ǿ�����ԣ�������������������ɶ�����̼��ͬʱ��������ԭ���ɶ��������ӣ����ӷ�Ӧ����ʽΪ��5H2C2O4+2MnO4-+6H+=10CO2��+2Mn2++8H2O��
���������ʵ���Ϊxmol����
5H2C2O4+6H++2MnO4-=10CO2��+2Mn2++8H2O
5mol 2mol
x 0.0500mol•L-1��0.015L
���ԣ�5mol��2mol=x��0.0500mol•L-1��0.015L
���x=0.001875mol��
���䴿��Ϊ��$\frac{0.001875mol��126g/mol}{0.25g}$��100%=94.5%��
�ʴ�Ϊ��5H2C2O4+2MnO4-+6H+=10CO2��+2Mn2++8H2O��94.5%��
���� ���⿼���Ʊ���������ƣ���Ŀ�Ѷ��еȣ�ע����ȷ����ʱ�����Ļ�ѧ��Ӧ�������IJ������ƣ��ѵ��Ǽ������ᾧˮ����Ĵ��ȣ���Ҫ���ݷ���ʽ���з����������������ѧ���ķ�����������ѧʵ��������


 ���ſ����ϵ�д�
���ſ����ϵ�д� ���Ŀ����ϵ�д�
���Ŀ����ϵ�д� ������ӱ������ͯ������ϵ�д�
������ӱ������ͯ������ϵ�д� A�ӽ��� ϵ�д�
A�ӽ��� ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
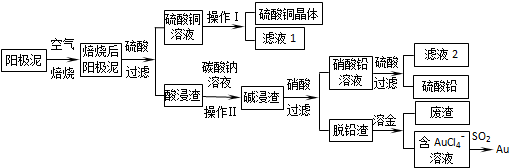
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������Ԫ���⣬������Ԫ�ص�����ϼ�����ֵ�϶����ڸ�Ԫ�������������� | |
| B�� | ���������⣬�������ھ���18��Ԫ�� | |
| C�� | �����Ԫ����ָ��A�������Ԫ�� | |
| D�� | ����Ԫ����û�зǽ���Ԫ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
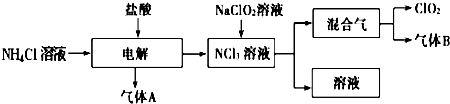
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Z���۵�ϸ� | B�� | Z���Ա�ʾΪM2Y | ||
| C�� | Z����������ˮ | D�� | M�γ�+2�۵������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
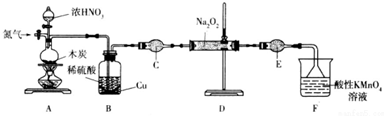
 ��ͼ�е�ʵ��װ����ȡ��Ȳ��
��ͼ�е�ʵ��װ����ȡ��Ȳ�� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com