
【题目】NH4HCO3是一种离子化合物,下列关于该物质的叙述错误的是( )
A.所含四种元素的原子半径由小到大的顺序为:H<O<N<C
B.同周期的三种元素的得电子能力由大到小的顺序为:O>N>C
C.与足量烧碱溶液共热的离子方程式为:NH4++OHˉ ![]() NH3↑+H2O
NH3↑+H2O
D.除去NaCl固体中混有少量的NH4HCO3固体可以采用加热的方法
【答案】C
【解析】解:A.不同周期的元素,元素的原子核外电子层数越多,原子半径就越大,同一周期的元素,原子序数越大,原子半径就越小,所以原子半径:所含四种元素的原子半径由小到大的顺序为:H<O<N<C,故A正确; B.同一周期的元素,原子序数越大,元素的非金属性就越强,得到电子的能力就越强,所以同周期的三种元素的得电子能力由大到小的顺序为:O>N>C,故B正确;
C.与足量烧碱溶液共热时阳离子、阴离子都发生反应,相应的离子方程式为:NH4++HCO3﹣+2OHˉ ![]() NH3↑+2H2O,故C错误;
NH3↑+2H2O,故C错误;
D.由于NH4HCO3不稳定受热容易分解产生氨气、CO2和H2O,而NaCl受热不分解,所以除去NaCl固体中混有少量的NH4HCO3固体可以采用加热的方法,故D正确.
故选C.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】有aW、bX、cY、dZ四种短周期元素,已知![]() ,且W、X、Y的最外层电子数总和大于Z的最外层电子数。下列说法不正确的是
,且W、X、Y的最外层电子数总和大于Z的最外层电子数。下列说法不正确的是
A. W元素的单质常温下是气体
B. X是蛋白质的组成元素之一
C. Y元素的单质能与冷水发生剧烈反应
D. Z元素的气态氢化物的水溶液呈酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种突破传统电池设计理念的镁—锑液态金属储能电池工作原理如下图所示,该电池所用液体密度不同,在重力作用下分为三层,工作时中间层熔融盐的组成及浓度不变。该电池工作一段时间后,可由太阳能电池充电。下列说法不正确的是
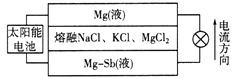
A. 放电时,Mg(液)层的质量减小
B. 放电时正极反应为:Mg2++2e—=Mg
C. 该电池充电时,Mg—Sb(液)层发生还原反应
D. 该电池充电时,C1—向中层和下层分界面处移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知实验室在加热条件下制取Cl2的化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。现将8.7 g MnO2投入到200 g质量分数为36.5%(过量)的浓盐酸中加热,充分反应后,求:
MnCl2+Cl2↑+2H2O。现将8.7 g MnO2投入到200 g质量分数为36.5%(过量)的浓盐酸中加热,充分反应后,求:
(1)标准状况下生成Cl2的体积。
(2)反应生成的MnCl2的质量为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是 ( )
A. 标准状况下,18gH218O所含质子数为10NA
B. 1molOH-所含有的电子数为9NA
C. Na2O2与H2O的反应中,每生成0.1molO2,转移电子数目为0.2NA
D. 1molMgCl2中含有的离子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盛有NO和NO2 的混合气体的量筒倒立在盛有水的水槽中,过一段时间后,量筒内的气体体积减小为原来的一半.
(1)写出有关反应的化学方程式.
(2)原混合气体中NO和NO2的体积比是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、N、W六种元素在周期表中的位置如图所示,下列说法不正确的是
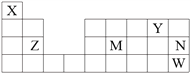
A. 原子半径:r(Z)>r(M)>r(Y)
B. 最高价氧化物对应水化物酸性:M>N
C. N的单质能与Z和W形成的化合物发生置换反应
D. X能与另五种元素形成化合物,且X的化合价不完全相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com