
| 溶质 | NaCl | Na2CO3 | NaClO | NaHCO3 |
| pH | 7 | 11.6 | 9.7 | 8.3 |
| A. | 在相同温度下,同浓度的三种酸溶液的导电能力:HCl>H2CO3>HClO | |
| B. | 等体积等物质的量浓度的NaCl溶液与NaClO溶液中Cl-和ClO-离子个数:Cl->ClO- | |
| C. | 向Na2CO3溶液中逐滴滴入少量稀盐酸,反应为:Na2CO3+2HCl=2NaCl+CO2↑+H2O | |
| D. | 若将CO2通入0.1mol/L Na2CO3溶液至溶液中性,则溶液中:2c(CO32-)+c(HCO3-)=0.2mol/L |
分析 相同条件下,酸的酸性越弱,其盐溶液的水解程度越大,盐溶液的碱性越强,已知溶液的pH大小关系,则酸性:HCl>H2CO3>HClO;
A.溶液中离子浓度越大,溶液的导电能力越强;
B.ClO-在溶液中会发生水解;
C.向Na2CO3溶液中逐滴滴入少量稀盐酸生成碳酸氢钠和氯化钠;
D.根据电荷守恒分析.
解答 解:相同条件下,酸的酸性越弱,其盐溶液的水解程度越大,盐溶液的碱性越强,已知溶液的pH大小关系,则酸性:HCl>H2CO3>HClO;
A.酸性:HCl>H2CO3>HClO,溶液中离子浓度越大,溶液的导电能力越强,在相同温度下,同浓度的三种酸溶液的导电能力:HCl>H2CO3>HClO,故A正确;
B.ClO-在溶液中会发生水解,所以等体积等物质的量浓度的NaCl溶液与NaClO溶液中Cl-和ClO-离子个数:Cl->ClO-,故B正确;
C.向Na2CO3溶液中逐滴滴入少量稀盐酸生成碳酸氢钠和氯化钠,其反应的方程式Na2CO3+HCl=NaHCO3+NaCl,故C错误;
D.若将CO2通入0.1mol/L Na2CO3溶液至溶液中性,电荷守恒为c(H+)+c(Na+)=c(OH-)+2c(CO32-)+c(HCO3-),则溶液中:c(Na+)=2c(CO32-)+c(HCO3-)=0.2mol/L,故D正确.
故选C.
点评 本题考查了盐的水解、弱电解质的电离,题目难度中等,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及灵活应用所学知识的能力,明确盐的水解原理、弱酸的电离特点以及溶液中的守恒关系为解答关键.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:解答题
| 化学键 | Si-Si | O=O | Si-O |
| 键能/kJ•mol-1 | a | b | c |


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.400mol•L-1 | B. | 0.300mol•L-1 | C. | 0.200mol•L-1 | D. | 0.100mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 ;
; ;
;
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 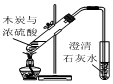 用如图所示装置验证反应产物二氧化碳 | |
| B. | 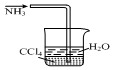 用如图装置吸收氨气并防止倒吸 | |
| C. |  如图装置配制100 mL 1 mol•L-1的硫酸 | |
| D. | 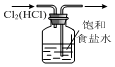 用如图装置除去氯气中的氯化氢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3的电子式: | |
| B. | CS2分子的球棍模型: | |
| C. | 二氧化硅的分子式:SiO2 | |
| D. | Mg5(Si4O10)2(OH)2•4H2O的氧化物形式:5MgO•8SiO2•5H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
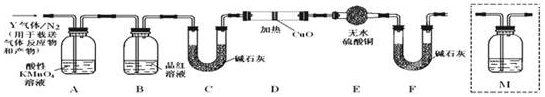
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 滴定次数 实验数据(mL) | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com