
下图为周期表中原子体积(单质原子的摩尔体积)随原子
序数变化的关系。
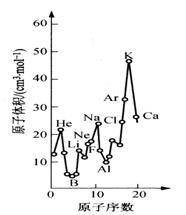 (1)第二周期原子体积最大的元素形成的固态单质属于
(1)第二周期原子体积最大的元素形成的固态单质属于
_________________晶体。第三周期原子体积最小的
元素核外电子排布式为________________________。
(2)试预测下列元素原子体积的关系:Se _____ Br;
Xe _____ Ba(选填 >、 = 或 < )。
(3)从图中可以得出的结论有__________(选填代号)。
a. 同一周期中,原子体积先由大变小,而后又
由小变大
b. 同周期金属元素中,碱金属的原子体积最大
c. 同一主族中从上到下,原子体积一般总是逐
渐减小
(4)由此可见,在元素周期表中,元素性质与它们
所形成的单质和化合物的性质均有周期性变
化规律。试写出一条ⅦA族元素所形成的化
合物某种性质的变化规律:
_____________________________。
 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
 (2012?南通模拟)Ⅰ.顺铂是美国教授B Rosenberg等人于1969年发现的第一种具有抗癌活性的金属配合物,它的化学式为Pt(NH3)2Cl2.1995年WHO对上百种治癌药物进行排名,顺铂的综合评价列第2位.
(2012?南通模拟)Ⅰ.顺铂是美国教授B Rosenberg等人于1969年发现的第一种具有抗癌活性的金属配合物,它的化学式为Pt(NH3)2Cl2.1995年WHO对上百种治癌药物进行排名,顺铂的综合评价列第2位.
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ① | |||||||||||||||||
| ② | ③ | ④ | ⑤ | ⑥ | |||||||||||||
| ⑦ | ⑧ | ||||||||||||||||
| ⑨ | ⑩ |

| M | ||
4
|
| M | ||
4
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | Z | |
| I1 | 496 | 738 | 577 |
| I2 | 4562 | 1451 | 1817 |
| I3 | 6912 | 7733 | 2754 |
| I4 | 9540 | 10540 | 11578 |
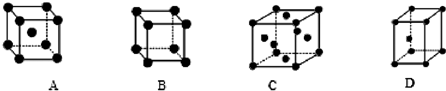
查看答案和解析>>
科目:高中化学 来源:河北省张家口沽源一中2012届高三高考预测化学试题 题型:022
已知A、B、C、D、E、F为周期表前四周期原子序数依次增大的六种元素.其中A是元素周期表中原子半径最小的元素,B原子最外层电子数是内层电子数的2倍.D、E为同主族元素,且E的原子序数为D的2倍.F元素在地壳中含量位于金属元素的第二位.试回答下列问题:
(1)F元素价层电子排布式为________.
(2)关于B2A2的下列说法中正确的是________.
A.B2A2中的所有原子都满足8电子结构
B.每个B2A2分子中σ键和π键数目比为1∶1
C.B2A2是由极性键和非极性键形成的非极性分子
D.B2A2分子中的B-A键属于s-spσ键
(3)B和D形成的一种三原子分子与C和D形成的一种化合物互为等电子体,则满足上述条件的B和D形成的化合物的空间构型是________.
(4)C元素原子的第一电离能比B、D两元素原子的第一电离能高的主要原因________.
(5)A与D可以形成原子个数比分别为2∶1,1∶1的两种化合物X和Y,其中Y含有________键(填“极性键”“非极性键”),A与C组成的两种化合物M和N所含的电子数分别与X、Y相等,则M的电子式为________,N的结构式为________.
(6)E的氢化物的价层电子对互斥理论模型为________,E原子的杂化方式为________杂化.
(7)F单质的晶体在不同温度下有两种堆积方式,晶胞分别如下图所示.面心立方晶胞和体心立方晶胞的棱边长分别为acm、bcm,则F单质的面心立方晶胞和体心立方晶胞的密度之比为________,F原子配位数之比为________.
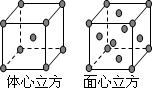
查看答案和解析>>
科目:高中化学 来源:2012届广西武鸣高中高二上学期期末考试理综化学部分 题型:填空题
各物质之间的转换关系如下图,部分生成物省略。C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10。D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,l有漂白作用,反应①常用于制作印刷电路板。

 请回答下列问题:
请回答下列问题:
(1)写出A的化学式 , C的电子式 。
 (2)由X、Y、Z三种元素按原子个数比为4:1:1形成的化合物的结构简式为
。
(2)由X、Y、Z三种元素按原子个数比为4:1:1形成的化合物的结构简式为
。
(3)写出反应②的化学方程式(有机物用结构简式表示) ,
由X、Y两元素形成的分子量为72的化合物的同分异构体共有 种,其中在光照下与Cl2反应其一氯取代物有4种的化合物的名称为 。
 (4)已知F溶于稀硝酸,溶液变成蓝色,并放出无色气体。请写出该反应的化学方程式
。
(4)已知F溶于稀硝酸,溶液变成蓝色,并放出无色气体。请写出该反应的化学方程式
。
(5)研究表明:气体D在一定条件下可被还原为晶莹透明的晶体N,其结构中原子的排列为正四面体,请写出N及其2种同素异形体的名称 、 、 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com