
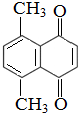
 )的衍生物,且与A互为同分异构体.
)的衍生物,且与A互为同分异构体.分析 (1)根据A的结构简式可知其分子式为C12H10O2;A分子中含有1个苯环(苯环与氢气按照1:3反应)、1个碳碳双键、2个碳氧双键,据此计算1molA与氢气发生加成反应最多消耗氢气的物质的量;A与氢气加成后的产物中含有两个环状结构,每个环比烷烃少2个H原子,据此判断A加氢后的产物比同碳原子数的烷烃少的H原子数;
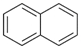
(2)A、B互为同分异构体,将A分子的两个环变为萘环( ),相当于环内增加1个双键,则侧链少1个双键,只剩下1个双键;则推出B的分子结构含1个萘环,侧链有2个C原子、两个O原子和若干H原子,且有1个双键;若B分子含有与萘环相连的-CHO,则除萘环外,侧链含有1个C原子、1个O原子,若干H原子,只有单键,据此推断其组成的取代基的结构简式.
),相当于环内增加1个双键,则侧链少1个双键,只剩下1个双键;则推出B的分子结构含1个萘环,侧链有2个C原子、两个O原子和若干H原子,且有1个双键;若B分子含有与萘环相连的-CHO,则除萘环外,侧链含有1个C原子、1个O原子,若干H原子,只有单键,据此推断其组成的取代基的结构简式.
解答 解:(1)根据A的结构简式可知,A分子中含有12个C、10个H和2个O原子,其分子式为:C12H10O2;A分子中含有1个苯环(苯环与氢气按照1:3反应)、1个碳碳双键、2个碳氧双键,1molA与氢气发生加成反应,最多消耗氢气的物质的量为:(4+1+2)mol=7mol;A与氢气加成后的产物中含有两个环状结构,每个环比烷烃少2个H原子,则A加氢后的产物比同碳原子数的烷烃少4个H原子,
故答案为:C12H10O2;7;4;
(2)A、B互为同分异构体,将A分子的两个环变为萘环( ),相当于环内增加1个双键,则侧链少1个双键,只剩下1个双键;则推出B的分子结构含1个萘环,侧链有2个C原子、两个O原子和若干H原子,且有1个双键,
),相当于环内增加1个双键,则侧链少1个双键,只剩下1个双键;则推出B的分子结构含1个萘环,侧链有2个C原子、两个O原子和若干H原子,且有1个双键,
若B分子含有与萘环相连的-CHO,则除萘环外,侧链含有1个C原子、1个O原子,若干H原子,只有单键,则可组合成的结构由3种:-CH2OH、-OCH3、-OH和CH3,
故答案为:-CH2OH、-OCH3、-OH和CH3.
点评 本题考查了有机物结构与性质、同分异构体的求算,题目难度中等,注意掌握常见有机物结构与性质,明确同分异构体的能够及书写原则,试题培养了学生的分析能力及逻辑推理能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 碘是人体所必需的因素之一回答以下有关碘的问题:
碘是人体所必需的因素之一回答以下有关碘的问题:| KI起始浓度/mol•L-1 | 0.02 | 0.04 | 0.06 | 0.08 | 0.10 |
| I3-% | 88.98 | 88.04 | 85.28 | 82.26 | 79.23 |
| I42-% | 4.38 | 8.67 | 12.60 | 16.21 | 19.53 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
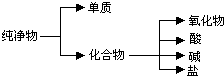 (1)纯净物根据其组成和性质可进行如图分类:如图所示的分类方法属于B(填序号)
(1)纯净物根据其组成和性质可进行如图分类:如图所示的分类方法属于B(填序号)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸碱中和反应属放热反应 | |
| B. | 化学变化中的能量变化主要由化学键变化引起的 | |
| C. | 煤、石油、天然气是当今世界最重要的三种化石燃料 | |
| D. | 相同条件下,1mol石墨转化为金刚石要吸收1.895kJ热量,说明金刚石比石墨稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 共价化合物:是否含有共价键 | |
| B. | 氧化还原反应:元素化合价是否变化 | |
| C. | 强弱电解质:溶液的导电能力大小 | |
| D. | 溶液与胶体:本质不同的原因是能否发生丁达尔效应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com