
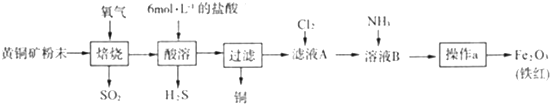
分析 (1)固体的焙烧在坩埚内进行;操作a的目的是将溶液B中产生的氢氧化铁沉淀过滤出来,再灼烧得氧化铁;
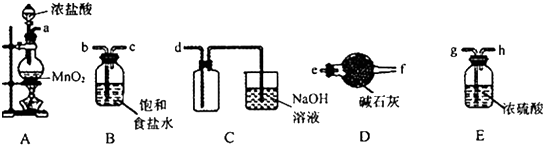
(2)①圆底烧瓶中发生反应为MnO2与浓盐酸反应生成Cl2、MnCl2、H2O;
②生成的Cl2含有HCl、H2O,所以a连接b、c,通过饱和食盐水除去HCl、继续连接g、h,通过浓硫酸,除去H2O,再连接d,即可收集纯净、干燥的氯气;
③利用加热气体膨胀的原理进行装置气密性的检验;
(3)根据Fe元素守恒可得:2CuFeS2~Fe2O3,以此计算该黄铜矿中含CuFeS2的质量分数.
解答 解:(1)固体的焙烧在坩埚内进行,操作a的目的是将溶液B中产生的氢氧化铁沉淀过滤出来,再灼烧得氧化铁,所以操作a为过滤、洗涤、干燥、灼烧,
故答案为:坩埚;过滤、洗涤、干燥、灼烧;
(2)①圆底烧瓶中发生反应为MnO2与浓盐酸反应生成Cl2、MnCl2、H2O,离子方程式为:MnO2+4H++2Cl?$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl?$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
②生成的Cl2含有HCl、H2O,所以a连接b、c,通过饱和食盐水除去HCl、继续连接g、h,通过浓硫酸,除去H2O,再连接d,即可收集纯净、干燥的氯气;
故答案为:b→c→g→h→d;
③利用加热气体膨胀的原理进行装置气密性的检验,所以检验方法为:关闭分液漏斗的活塞,将导管插入水中,微热圆底烧瓶,若导管末端产生气泡,停止加热,导管中有一段水柱形成,说明装置不漏气;
故答案为:关闭分液漏斗的活塞,将导管插入水中,微热圆底烧瓶,若导管末端产生气泡,停止加热,导管中有一段水柱形成,说明装置不漏气;
(3)根据Fe元素守恒可得:2CuFeS2~Fe2O3,所以该黄铜矿中含CuFeS2的质量分数=$\frac{8g×368}{20g×160}$×100%=92%,故答案为:92%.
点评 本题考查了物质制备过程分析判断,物质性质的理解应用,化学方程式和离子方程式书写方法,掌握基础是关键,题目难度较大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3-在水溶液中的水解方程式:HCO3-+H2O?H3O++CO32- | |
| B. | 用加热的方法可以除去KCl溶液中的Fe3+ | |
| C. | AlCl3溶液和NaAlO2溶液分别加热、蒸干,得到成分相同的固体Al(OH)3 | |
| D. | NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓盐酸在此反应中只体现还原性 | |
| B. | 产生0.1mol Cl2时转移电子数目为NA | |
| C. | 还原剂和还原产物的物质的量之比为2:1 | |
| D. | 当有0.2mol氧化剂参与反应时,标准状况下该反应产生气体的体积为6.72L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | IBr是双原子分子 | |
| B. | 在很多反应中IBr是氧化剂 | |
| C. | 和水反应时IBr既是氧化剂又是还原剂 | |
| D. | 和NaOH溶液反应生成NaBr和NaIO |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气是一种具有刺激性气味的无色气体 | |
| B. | 新制氯水可使蓝色石蕊试纸先变红后褪色 | |
| C. | 光照氯水有气泡逸出,该气体是Cl2 | |
| D. | 铁分别与氯气、盐酸反应时得到相同的氯化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅可用于制作半导体材料 | B. | 纯碱可用于制胃酸中和剂 | ||
| C. | 漂白粉可用于自来水的杀菌消毒 | D. | 甲醛可以用于食品防腐剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com