
| A. | 四个C-H键完全相同 | B. | CH4的一氯代物只有一种 | ||
| C. | CH2Cl2只有一种空间结构 | D. | 在常温常压下CH2Cl2为液体 |
分析 如果甲烷是正方形的平面结构,而CH2Cl2有两种结构:相邻或者对角线上的氢被Cl取代,而实际上,其二氯取代物只有一种结构,因此只有正四面体结构才符合.
解答 解:A.无论甲烷分子是以碳原子为中心的正四面体结构,还是平面正方形结构,CH4中的四个键的键角和键长都相等,故A错误;
B.无论甲烷分子是以碳原子为中心的正四面体结构,还是平面正方形结构,CH3Cl都不存在同分异构体,故B错误;
C.甲烷是正方形的平面结构,而CH2Cl2有两种结构:相邻或者对角线上的氢被Cl取代,而实际上,其CH2Cl2只有一种空间结构,因此只有正四面体结构才符合,故C正确;
D.在常温常压下CH2Cl2为液体,与结构无关,故D错误;
故选C.
点评 本题考查常见有机化合物的结构,题目难度中等,注意CH2Cl2只代表一种物质,可以证明甲烷分子是空间正四面体结构,而不是平面正方形结构.


科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
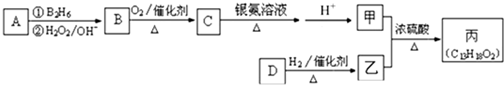
 -CH=CHCHO
-CH=CHCHO -CH2CH2CH2OH
-CH2CH2CH2OH (CH3)2CHCOOCH2CH2CH2-
(CH3)2CHCOOCH2CH2CH2- +H2O
+H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7 | |
| B. | 在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 | |
| C. | 二氧化碳溶于水能部分电离,故二氧化碳属于弱电解质 | |
| D. | 在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)═c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.75 mol•L-1 | B. | 1.5 mol•L-1 | C. | 2 mol•L-1 | D. | 0.15 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 离子 | Ca2+ | Fe3+ |
| 完全沉淀时的pH | 13 | 3.7 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
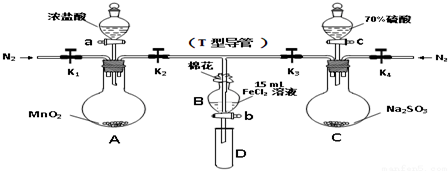
| 过程ⅣB溶液中含有的离子 | 过程ⅥB溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
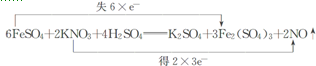 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com