
【题目】化学与生产、生活密切相关.下列叙述正确的是
A.煤的干馏和煤的液化均是物理变化
B.“光化学烟雾”、“硝酸酸雨”的形成都与氮氧化合物有关
C.糖类、油脂、蛋白质都是天然有机高分子化合物
D.用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理相同
 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
【题目】(1)将1.0 mol CH4和2.0molH2O(g)通入容积固定为10 L的反应容器中,在一定条件下发生反应:CH4(g)+H2O(g) ![]() CO (g)+3H2(g) ,测得在一定的压强下CH4的转化率与温度的关系如图1。
CO (g)+3H2(g) ,测得在一定的压强下CH4的转化率与温度的关系如图1。


①该反应的ΔH 0(填“>”“<”或“=”)
②假设100 ℃时达到平衡所需的时间为3 min,则用H2表示该反应的平均反应速率为 mol/(L·min)。
③100℃时该反应的平衡常数的数值为 。
④可用来判断该反应达到平衡状态的标志有 (填字母)。
A.CO的含量保持不变
B.CH4浓度与CO浓度相等
C.ν正(CH4)=3ν逆(H2)
D.混合气体的密度保持不变
E.混合气体的总物质的量保持不变
F.混合气体的压强度保持不变
(2)生成甲醇的反应:CO(g)+2H2(g)![]() CH3OH(g) △H =—129.0 kJ/mol,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图2所示。下列说法正确的是 (填字母)。
CH3OH(g) △H =—129.0 kJ/mol,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图2所示。下列说法正确的是 (填字母)。
A.温度:T1>T2 > T3
B.正反应速率:ν(a)>ν(c); ν(b)>ν(d)
C.平衡常数: K(a)>K(c) ; K(b)=K(d)
D.平均摩尔质量:M(a) >M(c); M(b)>M(d)
(3)工业上利用甲醇制备氢气的常用方法之一为:甲醇蒸气重整法。该法中的一个主要反应为CH3OH(g) ![]() CO(g)+2H2(g),此反应能自发进行的原因是 。
CO(g)+2H2(g),此反应能自发进行的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池的示意图如图所示。下列说法正确的是

A.放电时,N为负极,其电极反应式:PbO2+SO42-+4H++2e-=PbSO4+2H2O
B.放电时,c(H2 SO4)不变,两极的质量增加
C.充电时,阳极反应式:PbSO4+2e-=Pb+SO42-
D.充电时,若N连电源正极,则该极生成PbO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是中学化学常见单质,X、Y、Z、M、N、W、H、K是常见化合物,X是B和C的化合产物,它们之间有如下转化关系(反应物和产物中的H2O已略去):
(1)Y的电子式为 ,构成E单质的元素在周期表中位于第 周期第 族。
(2)反应①的离子方程式为 反应②的离子方程式为 反应③的离子方程式为
(3)某工厂用C制漂白粉。
①写出制漂白粉的化学方程式
②为测定该工厂制得的漂白粉中有效成分的含量,某小组进行了如下实验:称取漂白粉2.0g,研磨后溶解,配制成250mL溶液,取出25.00mL加入到锥形瓶中,再加入过量的KI溶液和过量的硫酸,此时发生的离子方程式为 ,静置。待完全反应后,用0.1mol·L-1的Na2S2O3溶液做标准溶液滴定反应生成的碘,已知反应式为:2Na2S2O3+I2=Na2S4O6+2NaI,共用去Na2S2O3溶液20.00mL。则该漂白粉中有效成分的质量分数为 (保留到小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器发生下列反应:aA(g)![]() cC(g)+dD(g),反应达到平衡后,将容器体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将容器体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A.平衡向正反应方向移动
B.a<c+d
C.D的体积分数增大
D.A的转化率变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、体积为2L的密闭容器中加入1molCO2和3molH2,发生如下的反应:
CO2(g)+3H2(g)![]() CH3OH(g) +H2O(g) △H<0。
CH3OH(g) +H2O(g) △H<0。
可认定该可逆反应在一定条件下已达到化学平衡状态的是( )
A.容器中CO2、H2、CH3OH、H2O的物质的量之比为1∶3∶1 ∶1
B.v正(CO2)=3v逆(H2)
C.容器内混合气体平均相对分子质量保持不变
D.容器中CO2、H2、CH3OH、H2O的物质的量浓度都相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同温度和压强下,对反应CO2(g)+H2O(g)![]() CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内的各组分的物质的量见下表
CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内的各组分的物质的量见下表
物质 物质的量 实验 | CO2 | H2 | CO | H2O |
甲 | a mol | a mol | 0mol | 0mol |
乙 | 2a mol | a mol | 0mol | 0mol |
丙 | 0mol | 0mol | a mol | a mol |
丁 | a mol | 0mol | a mol | a mol |
上述四种情况达到平衡后,n(CO)的大小顺序是
A.乙=丁>丙=甲 B.乙>丁>甲>丙 C.丁>乙>丙=甲 D.丁>丙>乙>甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】低温脱硝技术可用于处理废气中的氮氧化物, 发生的化学反应为:
![]()
在恒容的密闭容器中,下列有关说法正确的是( )
A. 平衡时,其他条件不变,升高温度可使该反应的v(正)减小
B. 平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小
C. 单位时间内消耗NO和N2的物质的量比为1:2时,反应达到平衡
D. 其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据《天工开物》记载,我国古代以炉甘石(主要成分是ZnCO3)来冶炼倭铅(即锌),其原理如图2。已知锌的熔点420℃、沸点906℃。则下列说法错误的是( )

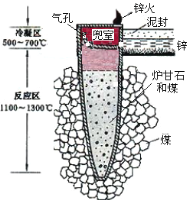
图1 图2
A.“泥封”的目的是为了防止得到的锌被氧化
B.“锌火”是锌蒸气和一氧化碳在空气的燃烧
C.冶炼时锌变为蒸气在兜室冷凝为固体
D.升炼倭铅过程包含分解反应和氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com