
【题目】有MgO、Al2O3、SiO2、Fe2O3组成的混合粉末。现取两份该混合粉末试样进行实验。
(1)将一份混合粉末溶于过量的盐酸,得到沉淀X和滤液Y
①沉淀X为_______(填化学式,下同), 滤液Y中含有的阳离子主要是_______。
②向滤液Y中加入过量氢氧化钠溶液,得到的沉淀是___________。
(2)将另一份混合粉末溶于过量氢氧化钠溶液,发生反应的离子方程式为___________。
【答案】SiO2 Al3+、Mg2+、Fe3+、H+ Mg(OH)2、Fe(OH)3 SiO2+2OH-=![]() +H2O、Al2O3+2OH-=2
+H2O、Al2O3+2OH-=2![]() +H2O
+H2O
【解析】
有MgO、Fe2O3属于碱性氧化物,与酸反应;Al2O3属于两性氧化物,与强酸强碱反应;SiO2属于酸性氧化物,与碱反应,据以上分析解答。
(1)①将混合粉末溶于过量盐酸中,仅SiO2不能和盐酸反应,故沉淀X为SiO2;滤液Y中含有MgCl2、AlCl3、FeCl3、HCl,故滤液Y中的阳离子有Al3+、Mg2+、Fe3+、H+;
②向滤液Y中加入过量NaOH溶液,可以的到Mg(OH)2、Al(OH)3、Fe(OH)3,其中只有Al(OH)3会继续和NaOH反应,故加入过量NaOH溶液所得沉淀为Mg(OH)2、Fe(OH)3;
(2)混合粉粉末中,SiO2、Al2O3可以和NaOH溶液反应,故该过程的离子方程式为:SiO2+2OH-=![]() +H2O、Al2O3+2OH-=2
+H2O、Al2O3+2OH-=2![]() +H2O。
+H2O。


科目:高中化学 来源: 题型:
【题目】某学习小组探究氨的还原性及检验产物的性质,按下图装置进行实验(图中夹持装置已略去)。将B处的三氧化二铬加热至红热,再鼓入空气,已知:无水氯化钙可吸收氨气和水。回答下列问题:
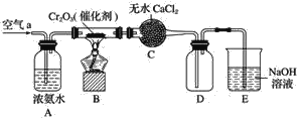
(1)B中发生反应的化学方程式是________________________________。
(2)证明氨气发生了催化氧化的现象是____________________________。
(3)写出(2)中反应的化学方程式______________________。
(4)装置E作用是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下氯气和氢气共aL,在光照下充分进行反应,反应后的气体恰好能使bmol 氢氧化钠完全转化成盐,则a、b的关系不可能是下列的( )
A. b<![]() B. b<
B. b<![]() C. b>
C. b>![]() D. b>
D. b>![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为了证明二氧化硫和氯气的漂白性,设计了如下图所示的实验装置:
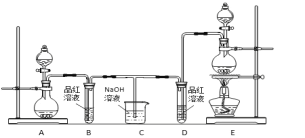
他们制备二氧化硫和氯气所依据的原理分别是:
Na2SO3+H2SO4 = Na2SO4+H2O+SO2↑
MnO2+4HCl(浓) ![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
(1)用来制取氯气的装置是______(填字母),反应中浓盐酸所表现出________________性质。
(2)反应开始一段时间后,B、D试管中的品红溶液均退色。停止通气后,再给B、D两个试管分别加热____ (填" B”或“D")试管中无明显现象。
(3)装置C的作用是________________________;
(4)若装置D中的品红溶液换成紫色的石蕊溶液,则出现的现象是____________________________;
(5)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不退色。查阅资料得知:两种气体按体积比1:1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的化学方程式是:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在50 mL 4 mol·L-1的氢氧化钠溶液中,通入一定量的硫化氢,反应完毕,在常温减压条件下,用氮气把溶液吹干,得到白色固体7.92 g,通过计算确定白色固体的组成及各组分的质量。_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关反应速率的说法正确的是( )
A.相同条件下,形状大小相同的Mg、Al 分别与同浓度的盐酸反应的速率相同
B.使用合适的催化剂可以加快反应速率,但不能提高反应物的转化率
C.在容积固定的恒温密闭容器中,发生合成NH3的反应,充入He,反应速率增大
D.10mL0.5mol·L-1的FeCl3溶液加入10mL的0.5mol·L-1的KSCN 溶液,充分反应后加入KCl固体,溶液颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.凡是放热反应都是自发的,凡是吸热反应都是非自发的
B.常温下反应 C(s)+CO2(g)![]() 2CO(g)不能自发进行,该反应的ΔH>0
2CO(g)不能自发进行,该反应的ΔH>0
C.自发反应的现象一定非常明显,非自发反应的熵一定减小
D.反应(NH4)2CO3(s)=NH4HCO3(s)+NH3(g) ΔH=+74.9kJ·mol-1在高温不能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍(Ni)及其化合物在工业生产中具有重要地位。如图是工业精制镍的基本流程示意图:
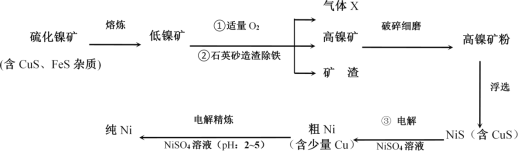
请按要求回答下列问题:
(1)写出流程图中组成气体X的元素中电负性较大的是__(填元素符号)。气体X的中心原子的杂化轨道类型为___,该分子的立体构型(即空间结构)为__。
(2)Ni2+核外电子排布式为__。
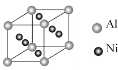
(3)向晶体Ni中掺入一定量的Al原子,会改变晶体Ni的(写一种物理性质)_。某种用于铸造飞机发动机叶片镍铝合金的晶胞结构如图所示,该合金的化学式为_。
(4)已知:常温下溶度积常数:Ksp(NiS)=1.07×10-21;Ksp(CuS)=1.27×10-36
工业生产中常用加NiS的方法除去溶液中的Cu2+,若过滤后溶液中c(Ni2+)为0.107mol·L-1,则滤液中残留的c(Cu2+)为_。写出流程图中③NiS在阳极参与放电的电极反应式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝热反应不仅用于焊接钢轨,而且还常用于冶炼熔点较高的金属如钒、铬、锰等。
请配平下列用铝热反应冶炼金属钒和钴的化学方程式,指出哪些物质是还原剂、哪些物质是氧化剂,并计算生成1 mol各种金属分别需要纯铝的质量。
V2O5+Al——Al2O3+V Co3O4+Al——Al2O3+Co
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com