
| A.某山区发现了一种“柴油树”,它产生的树油可替代柴油使用 |
| B.新型材料碳纳米管的化学性质常温下很稳定 |
| C.美国最新研制出一种燃料电池,其能量转化率很高,可达到100% |
| D.蜘蛛丝(主要成分是蛋白质分子)强度特别大,可以用来制造防弹衣和降落伞绳 |
科目:高中化学 来源:不详 题型:实验题
 可用于补钙抗过敏等,以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)生产医用二水合氯化钙(CaCl2 ·2H2O的质量分数为97.3—103.0%),工艺流程为:
可用于补钙抗过敏等,以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)生产医用二水合氯化钙(CaCl2 ·2H2O的质量分数为97.3—103.0%),工艺流程为: 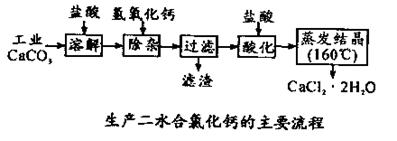

 结晶要保持在160℃: 。
结晶要保持在160℃: 。 。
。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
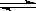 2NH3(g);已知:反应2min达到平衡,此时N2的浓度减少了2/3。
2NH3(g);已知:反应2min达到平衡,此时N2的浓度减少了2/3。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 极(填写正、负极)相连。
极(填写正、负极)相连。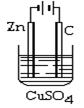
A.FeCl 2 2 | B.CuCl2 | C.K6[Cu(P2O7)2] | D.CuSO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.乙醇和汽油都是可再生资源,应大力推广“乙醇汽油” |
| B.可以用聚乙烯塑料作食品包装袋 |
| C.食品加工、消毒防腐常使用福尔马林 |
| D.钢铁在海水中比在河水中更易腐蚀,主要原因是海水含氧量高于河水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.使用高效催化剂分解水制得H2的同时还可以获得能量 |
| B.使用高效催化剂后常温下水可以自发分解 |
| C.硅胶具有多孔结构,有较大的表面积,常用做催化剂的载体 |
| D.对于可逆反应,催化剂在增大正反应速率的同时也增大逆反应速率 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
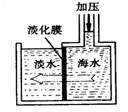
| A.溶质质量增加 | B.溶剂质量减少 |
| C.溶液质量不变 | D.溶质质量分数减少 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com