
【题目】下列说法正确的是 ( )
A. 将AlCl3溶液和Al2(SO4)3溶液分别加热、蒸干、灼烧,所得固体成分相同
B. 配制FeSO4溶液时,将FeSO4固体溶于稀盐酸中,然后稀释至所需浓度
C. 用分液的方法分离乙醇和水的混合溶液
D. 洗涤油污常用热的Na2CO3溶液
科目:高中化学 来源: 题型:
【题目】H、N、O、Na、S、Cl都是中学化学中的常见元素,根据题意回答与这些元素有关的问题:
(1)画出Na原子结构示意图_______,Na2O2可用作供氧剂,其电子式为_______。
(2)Cl2是一种大气污染物,装有液氯的钢瓶上应贴的标签是_______(填编号)。
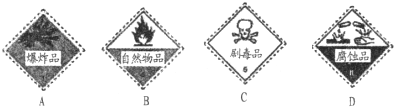
氯气泄漏可用NaHSO3溶液来处理,写出相关的离子反应方程式_____________。
(3)25C时,利用pH试纸测得0.1mol/L氨水的pH约为11,则可以估算出氨水的电离常数约为_____;向10mL此溶液中通入少量氨气,忽略溶解过程中溶液温度和体积的微小变化,溶液中![]() 将_______(填“增大” “减小”或“无法确定”)。
将_______(填“增大” “减小”或“无法确定”)。
(4)有两种化合物同时含有上述六元素中的四种元素。将这两种化合物的溶液混合后,恰好完全反应,生成物之一M仍含有这四种元素,该反应的离子方程式为______________。若M溶液的pH =5,则由水电离出的c(H+)=_______mol/L,该溶液离子浓度由大到小的顺序为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A.氯化铜溶液与锌粒反应:Cu2++Zn=Zn2++Cu
B.稀 H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑
C.铁与氯化铁溶液反应:Fe+Fe3+=2Fe2+
D.碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,第一种是混合物,第二种是盐,第三种是酸的是
A. 空气、硫酸铜、硫酸 B. 水、空气、纯碱
C. 食盐水、硝酸、烧碱 D. 氧化铁、胆矾、熟石灰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。下列说法错误的是( )
A.AgCl不溶于水,不能转化为AgI
B.在含有浓度均为0.001 mol·L-1的Cl-、I-的溶液中缓慢加入AgNO3稀溶液,首先析出AgI沉淀
C.AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于![]() ×10-11mol·L-1
×10-11mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能用H++OH-=H2O来表示的化学反应是( )
A.氢氧化镁和稀盐酸反应
B.Ba(OH)2溶液滴入稀硫酸中
C.二氧化碳通入澄清石灰水中
D.澄清石灰水和稀硝酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤化工中常需研究不同温度下平衡常数、投料比及热值等问题。
已知:CO(g)+H2O(g)![]() H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
试回答下列问题:
(1)上述正向反应是________(填“放热”或“吸热”)反应。
(2)在800 ℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有________(填下表中字母编号)。
n(CO) | n(H2O) | n(H2) | n(CO2) | |
A | 1 | 5 | 2 | 3 |
B | 2 | 2 | 1 | 1 |
C | 3 | 3 | 0 | 0 |
D | 0.5 | 2 | 1 | 1 |
(3)已知在一定温度下:
C(s)+CO2(g)![]() 2CO(g) 平衡常数K1;
2CO(g) 平衡常数K1;
C(s)+H2O(g)![]() CO(g)+H2(g) 平衡常数K2;
CO(g)+H2(g) 平衡常数K2;
CO(g)+H2O(g)![]() H2(g)+CO2(g) 平衡常数K;
H2(g)+CO2(g) 平衡常数K;
则K、K1、K2之间的关系是________。
(4)若在500 ℃时进行,设起始时CO和H2O的起始浓度均为0.020 mol·L-1,在该条件下,CO平衡时的转化率为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2和I2在一定条件下能发生反应H2(g)+I2(g)![]() 2HI (g) △H=-a kJmol-1,已知:
2HI (g) △H=-a kJmol-1,已知:
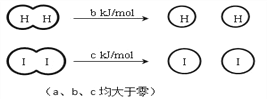
下列说法不正确的是
A. 反应物的总能量高于生成物的总能量
B. 向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ
C. 断开2 mol H-I键所需能量约为(c+b+a) kJ
D. 断开1 mol H-H键和1 mol I-I键所需能量大于断开2 mol H-I键所需能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1
Na2O2(s)+CO2(g)=Na2CO3(s)+![]() O2(g) ΔH=-266 kJ·mol-1
O2(g) ΔH=-266 kJ·mol-1
根据以上热化学方程式判断,下列说法正确的是( )
A.CO的标准燃烧热为283 kJ
B.下图可表示由CO生成CO2的反应过程和能量关系
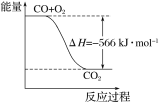
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-532 kJ·mol-1
D.CO(g)与Na2O2(s)反应放出549 kJ热量时,电子转移数为6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com