
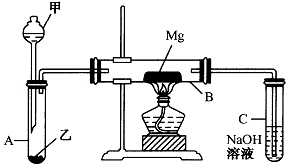
 已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性.
已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性.分析 (1)依据强酸制备弱酸的原理,结和物质的性质,选择实验室制备SO2的试剂;
(2)根据Mg与CO2的反应知Mg与SO2反应能生成氧化镁与单质硫,但单质硫能与镁反应生成硫化镁;二氧化硫有毒,不能直接排放到空气中,可用氢氧化钠吸收过量的二氧化硫;
(3)该装置中:①A中的水蒸气会进入B与Mg反应,在A、B中间应加干燥装置;②Mg能与SiO2反应,在Mg下方垫一不锈钢片,隔离Mg和SiO2;③尾气处理装置C试管用胶塞封闭,且无防倒吸装置;
(4)发现有爆鸣声和火花,说明生成气体,应为SiH4.
解答 解:(1)制取SO2应用浓H2SO4和亚硫酸盐,选项中不可选用CaSO3,因为CaSO3微溶于水,会附在固体表面,阻碍反应进行,
故答案为:②③;
(2)Mg具有还原性,SO2具有氧化性,两者发生氧化还原反应,反应的方程式为3Mg+SO2$\frac{\underline{\;\;△\;\;}}{\;}$2MgO+MgS(或2Mg+SO2$\frac{\underline{\;\;△\;\;}}{\;}$2MgO+S,Mg+S$\frac{\underline{\;\;△\;\;}}{\;}$MgS),二氧化硫可与碱反应,易防止污染空气,
故答案为:3Mg+SO2$\frac{\underline{\;\;△\;\;}}{\;}$2MgO+MgS(或2Mg+SO2$\frac{\underline{\;\;△\;\;}}{\;}$2MgO+S,Mg+S$\frac{\underline{\;\;△\;\;}}{\;}$MgS;吸收过量二氧化硫,防止污染环境;
(3)该装置中:①A中的水蒸气会进入B与Mg反应,在A、B中间应加干燥装置;②Mg能与SiO2反应,在Mg下方垫一不锈钢片,隔离Mg和SiO2;③尾气处理装置C试管用胶塞封闭,且无防倒吸装置,
故答案为:在A和B之间没有连接一个干燥装置、C装置未与大气相通、在镁下方未垫一个不锈钢片、镁与玻璃管反应、未设计一个防倒吸装置.
(4)发现有爆鸣声和火花,说明生成气体,应为SiH4,原因是发生2Mg+Si$\frac{\underline{\;\;△\;\;}}{\;}$Mg2Si,Mg2Si+2H2SO4═2MgSO4+SiH4↑,SiH4+2O2═SiO2+2H2O,金属镁与生成的硅继续反应生成硅化镁,硅化镁与稀硫酸反应生成的SiH4可自燃,
故答案为:2Mg+Si$\frac{\underline{\;\;△\;\;}}{\;}$Mg2Si,Mg2Si+2H2SO4═2MgSO4+SiH4↑,SiH4+2O2═SiO2+2H2O.
点评 本题为信息题,以镁和二氧化硅的反应为载体考查了二氧化硫的实验室制备及性质检验,侧重培养学生分析问题解决问题的能力,题目难度较大.


科目:高中化学 来源: 题型:解答题
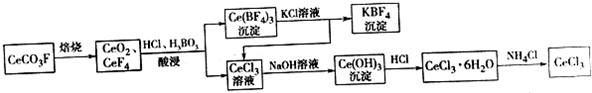
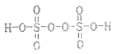 ,其中S元素的化合价为:+6.过硫酸铵(NH4)2Fe(SO4)2溶液将Ce3+氧化Ce4+为的离子方程式为:S2O42-+2Ce3+=2Ce4++2SO42-
,其中S元素的化合价为:+6.过硫酸铵(NH4)2Fe(SO4)2溶液将Ce3+氧化Ce4+为的离子方程式为:S2O42-+2Ce3+=2Ce4++2SO42-查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 现象 | 实验结论 | |
| A | 将SO2气体通入紫色石蕊试液中 | 溶液先变红后褪色 | 二氧化硫具有酸性和漂白性 |
| B | 将小苏打和硫酸应生成的气体,通入一定浓度的Na2SiO3溶液中 | 出现白色胶状沉淀 | 酸性:H2SO4>H2CO3>H2SiO3 |
| C | 将光亮的镁条放入盛有NH4Cl溶液的试管中 | 有大量气泡产生 | 反应中有NH3产生 |
| D | 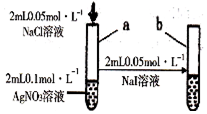 | 试管a出现白色沉淀,试管b出现黄色沉淀 | 溶度积:Ksp(AgCl)>Ksp(AgI) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入足量的NaOH溶液充分振荡后,用分液漏斗分液弃除下层溶液 | |
| B. | 加入溴水,生成三溴苯酚,再过滤除去 | |
| C. | 加水,加热超过 70℃(苯酚在热水中溶解度很大),然后用分液漏斗振荡分液后,弃除下层溶液 | |
| D. | 将混合物蒸馏(甲苯沸点110℃,苯酚沸点182℃),可先蒸出甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
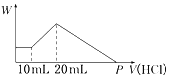 医学上常用酸性高锰酸钾溶液和草酸溶液的反应用于测定血钙的含量.回答下列问题:
医学上常用酸性高锰酸钾溶液和草酸溶液的反应用于测定血钙的含量.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0.1mol•L-1 Na2SO3溶液溶液中:c(Na+)═2c(SO32-)+c(HSO3-)+c(H2SO3) | |
| B. | 在0.1 mol•L-1Na2CO3溶液中:c(OH-)-c(H+)═c(HCO3-)+2c(H2CO3) | |
| C. | 向0.2 mol•L-1NaHCO3溶液中加入等体积0.1 mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,CH3COONa和CaCl2混合溶液中:c(Na+)+c(Ca2+)═c(CH3COOH)+c(CH3COO-)+2 c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
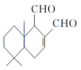 某天然拒食素具有防御非洲大群蚯蚓的作用,其结构简式如图(未表示出原子或原子团的空间排列).该拒食素与下列某试剂充分反应,所得有机物分子的官能团种数减少,则该试剂是( )
某天然拒食素具有防御非洲大群蚯蚓的作用,其结构简式如图(未表示出原子或原子团的空间排列).该拒食素与下列某试剂充分反应,所得有机物分子的官能团种数减少,则该试剂是( )| A. | H2 | B. | Cu(OH)2悬浊液 | C. | HBr | D. | Br2的CCl4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同质量的乙烯和甲烷完全燃烧后产生的水的质量相同 | |
| B. | 用溴的四氯化碳溶液或酸性KMnO4溶液都可以鉴别乙烯和乙烷 | |
| C. | 无论乙烯与Br2的加成,还是乙烯使酸性KMnO4溶液褪色,都与分子内含有碳碳双键有关 | |
| D. | 乙烯的化学性质比乙烷的化学性质活泼 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应速率发生了改变 | |
| B. | 有气态物质参加的可逆反应达到平衡后,改变了压强 | |
| C. | 某一条件的改变,使正、逆反应速率不再相等 | |
| D. | 可逆反应达到平衡,使用了催化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com