
����(H2)��һ����̼(CO)������(C8H18)������(CH4)���Ȼ�ѧ����ʽ�ֱ�Ϊ��
H2(g) + 1/2O2(g) = H2O(l) ��H= ��285.8 kJ/mol
CO(g) + 1/2O2(g) = CO2(g) ��H= ��283.0 kJ/mol
C8H18(l) + 25/2O2(g) = 8CO2(g) + 9 H2O(l) ��H= ��5518 kJ/molCH4(g) + 2 O2(g) = CO2(g) + 2 H2O(l) ��H= ��890.3 kJ/mol
��ͬ���ʵ�����H2��CO��C8H18��CH4��ȫȼ��ʱ���ų��������ٵ���( )
A��H2(g) B��CO(g) C��C8H18(l) D��CH4(g)

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��������ܶ���С�Ľ������������Ľ�������ͷų�����ĵ��ӣ��ʳ����������������ء���֪﮵Ľ����Խ����ƺ�þ֮�䣬��������ұ��������﮵ķ�����(����)
A����ⷨ��������B���Ȼ�ԭ�� C���ȷֽ��� D�����ȷ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��NAΪ�����ӵ�����, ����˵����ȷ���ǣ� ��
��A. ���³�ѹ�£�0.1NA��HCl���ӵ����Ϊ2.24L
��B. ��״���£�22.4L ��������2NA ��ԭ��
C. 1L 0.2mol/L ��������Һ�к��е�SO42- ������ĿΪ0.2 NA
D. 1 mol���к��еĵ�����Ϊ10NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����뻯ѧ��Ӧ�����仯��ص�������ȷ���� (���� )
A��������������һ�����ڷ�Ӧ��������
B�����ȷ�Ӧ�ķ�Ӧ�������Ǵ������ȷ�Ӧ�ķ�Ӧ����
C��Ӧ�ø�˹���ɣ��ɼ���ijЩ����ֱ�Ӳ����ķ�Ӧ�ʱ�
D��ͬ��ͬѹ�£�H2 (g)��Cl2(g)===2HCl(g)�ڹ��պ͵�ȼ�����µĦ�H��ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪���� 1molH2�����л�ѧ������ʱ��Ҫ����436kJ���������� 1molCl2�����л�ѧ������ʱ��Ҫ����243kJ���������� ��Hԭ�Ӻ�Clԭ���γ�1molHCl����ʱ�ͷ�431kJ������������������ȷ����( )
A��������������Ӧ�����Ȼ���������Ȼ�ѧ����ʽ��H2(g)��Cl2(g)===2HCl(g)
B��������������Ӧ����2mol�Ȼ������壬��Ӧ�ġ�H��183kJ/mol
C��������������Ӧ����2mol�Ȼ������壬��Ӧ�ġ�H����183kJ/mol
D��������������Ӧ����1mol�Ȼ������壬��Ӧ�ġ�H����183kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪1 g������ȫȼ������ˮ����ʱ�ų�����121 kJ����������1 mol O��O����ȫ����ʱ��������496 kJ��ˮ������1 mol H��O���γ�ʱ�ų�����463 kJ����������1mol H��H������ʱ��������Ϊ( )
A��920 kJ B��557 kJ C��436 kJ D��188 kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���ڹ̶�������ܱ������н��е����巴Ӧ����˵��A(g) + B(g) C(g)+D(g)�ں������Ѵﵽƽ�����(��)
C(g)+D(g)�ں������Ѵﵽƽ�����(��)
A����Ӧ������ѹǿ����ʱ����仯������B��A�����B����������������
C��A��B��C�������������������ȡ���D����Ӧ���������ܶȲ���ʱ����仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�ϳɰ���ӦΪ3H2+N2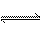 2NH3���䷴Ӧ���ʿ��Էֱ�Ϊv(H2)��v(N2)��v(NH3)��mol��(L��s)-1�ݱ�ʾ������ȷ�Ĺ�ϵʽΪ�� ��
2NH3���䷴Ӧ���ʿ��Էֱ�Ϊv(H2)��v(N2)��v(NH3)��mol��(L��s)-1�ݱ�ʾ������ȷ�Ĺ�ϵʽΪ�� ��
A.v(H2)=v(N2)=v(NH3) B.3v(H2)=v(N2)
C.v(NH3)=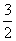 v(H2) D.v(H2)=3v(N2)
v(H2) D.v(H2)=3v(N2)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������ˮϡ��1 mol��L��1����ʱ��ʼ�ձ����������Ƶ��� �� ��
A����Һ�е�c(CH3COO��) B����Һ�е�c(H��)
C����Һ�е�c(CH3COOH) D����Һ�е�c(OH��)
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com