
【题目】以软锰矿(主要成分为MnO2,还含有少量的Fe2O3、FeO、Al2O3和SiO2)为原料制备马日夫盐[Mn(H2PO4)2·2H2O(磷酸二氢锰)]的主要工艺流程如图:

(1)用MnO2“氧化”时发生反应的离子方程式为__________________________________。
(2)如何检验“沉锰”己完成_____________________________________________________。
(3)铁离子的萃取率与接触时间和溶液的pH之间的关系如图1、2所示,则应选择的接触时间为_______;pH>1.7,铁离子的萃取率急剧下降的原因可能为____________________。

(4)结合图3的溶解度曲线,请补充完整由浸锰得到的溶液制备MnSO4·H2O的实验方案:边搅拌边向溶液中滴加适量的双氧水,再向滤液中加入MnCO3粉末调节溶液的pH范围为_________,过滤洗涤,将滤液与洗涤液合并,控制温度在80℃~90℃之间蒸发浓缩、______________,(填操作名称)得到MnSO4·H2O,用80℃~90℃的蒸馏水洗涤2~3次,放在真空干燥箱中低温干燥。[已知该溶液中pH=7.8时Mn(OH)2开始沉淀:pH=5.0时Fe(OH)3、Al(OH)3沉淀完全,pH=8.8时Fe(OH)2沉淀完全]。
【答案】2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O 在上层清液中继续滴加Na2CO3溶液,若无沉淀生成则说明沉锰已经完成 60min pH>1.7时铁离子水解生成Fe(OH)3沉淀 5.0≤pH<7.8 趁热过滤
【解析】
软锰矿(主要成分为MnO2,还含有少量的Fe2O3、FeO、Al2O3和SiO2)用硫酸和二氧化硫进行酸溶转化为Fe2+、Fe3+、Al3+、Mn2+ SO42-,过滤后得到的滤液中含有Fe2+、Fe3+、Al3+、Mn2+ SO42-,由于SiO2不与硫酸反应,则滤渣1主要含有SiO2,向滤液中加入二氧化锰,主要作用是将滤液中的二价铁离子氧化为三价铁离子,二氧化锰自身转变为锰离子,方便杂质离子除去,再向滤液中加入有机萃取剂,将滤液中的三价铁离子转到有机萃取剂中,此时滤液中还有Al3+、Mn2+ SO42-,为确保三价铁离子除干净,同时把铝离子除净,但又不能减少滤液中锰离子的量,将调节溶液PH值调节为5到7.8之间,可将滤液中可能残留的三价铁和铝离子,全部转化为氢氧化铁和氢氧化铝沉淀。再加入碳酸钠,将锰离子转变为碳酸锰沉淀,再用磷酸溶解,最后得到马日夫盐。
(1)“氧化”时酸性溶液中二氧化锰与亚铁离子反应生成三价铁离子,离子方程式为2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O;
答案为:2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O;
(2)若锰离子全部沉淀,那么溶液中再加入碳酸钠就不会产生沉淀,因此检验方法为在上层清液中继续滴加Na2CO3溶液,若无沉淀生成则说明沉锰已经完成;
答案为:取沉淀后的上层清液中继续滴加Na2CO3溶液,若无沉淀生成则说明沉锰已经完成;
(3)如图一所示,当接触60分钟时,萃取率达到最大,当pH>1.7时,Fe3+会发生水解转化为氢氧化铁沉淀,导致铁离子萃取率降低;
答案为:60min;pH>1.7时铁离子水解生成Fe(OH)3沉淀;
(4)实验目的是制备MnSO4·H2O,要将杂质离子处理干净,当PH=5时铁离子完全沉淀,结合已知条件溶液中pH=7.8时Mn(OH)2开始沉淀,溶液中锰离子的量就会减少,因此溶液的PH控制在5到7.8之间,杂质离子最少,溶液中锰离子的含量最高;根据图三所示,当溶液中温度为23.9℃左右,MnSO4·H2O的溶液度最大,温度越高,MnSO4·H2O晶体析出越多,趁热过滤得到的产品的产率最高;
答案为:5.0≤pH<7.8;趁热过滤。


科目:高中化学 来源: 题型:
【题目】

(1)通过不休眠种子与休眠种子胚的鲜重比较,得出其中结合水/自由水比值高的是_______种子;不休眠的种子萌发6天后至形成叶片前,干重会____________,原因是:____________。
(2)不休眠的种子萌发后胚中的RNA合成量____________,经分析种子的淀粉含量下降而葡萄糖含量升高,推测某些RNA控制翻译合成了______________。
(3)第5天萌发种子的胚根长出,此时整个种子内DNA的含量与不萌发种子比__________(相等、增多、减少),推测的理由是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香化合物A是一种基本化工原料,可以从煤和石油中得到。A、B、C、D、E的转化关系如图所示:回答下列问题:
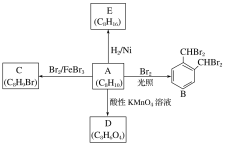
⑴A的化学名称是______;与A互为同分异构体的芳香化合物还有 _____种,其中核磁共振氢谱图上显示有5个峰,且峰面积之比为1:2:2:2:3的物质的结构简式为:________________。
⑵A→B的反应类型是_______。
⑶A→E的化学方程式为____________________。
⑷A与酸性KMnO4溶液反应可得到D,写出D的结构简式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。说法正确的是( )

A. X与W形成的化合物中只有共价键
B. X与Z形成的化合物中只有离子键
C. 元素的非金属性:X>R>W
D. 简单离子的半径:W>R>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是________________(填序号),配制上述溶液还需用到的玻璃仪器是_____________(填仪器名称)。

(2)配制0.1mol/L NaOH 溶液操作步骤如下:正确顺序是___________________
①把称量好的NaOH固体放入小烧杯中,加适量的蒸馏水溶解;
②把①所得溶液冷却至室温,再小心转入一定容积的容量瓶中;
③继续向容量瓶中加蒸馏水至液面距刻度线1~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面与刻度线相切;
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀;
⑤将容量瓶瓶塞塞紧,充分摇匀.
(3)根据计算用托盘天平称取NaOH的质量为______g.在实验中其他操作均正确,若容量瓶用蒸馏水洗涤后未干燥,则所得溶液浓度_________0.10mol/L(填“大于”“小于”或“等于”,下同).若还未等溶液冷却就定容了,则所得溶液浓度___________0.10mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一般较强酸可制取较弱酸,这是复分解反应的规律之一。已知在常温下测得浓度均为0.1mol/L的下列 3 种溶液的 pH:
溶质 | NaHCO3 | Na2CO3 | NaClO |
pH | 8.34 | 11.6 | 10.3 |
下列有关说法正确的是( )
A. 以上溶液的 pH 是用广泛 pH 试纸测定的
B. 反应CO2+H2O+2NaClO=Na2CO3+2HClO可以发生
C. 室温下,电离常数: K2( H2CO3)>K( HClO)
D. 在新制氯水中加入少量 NaHCO3固体可以提高溶液中 HClO 的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组微粒的空间构型相同的是
①NH3和H2O ②NH4+和H3O+ ③NH3和H3O+ ④O3和SO2 ⑤CO2和C2H2 ⑥SiO44-和SO42-
A. ②⑤B. ②③⑥C. ①②③④D. ③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体育竞技中服用兴奋剂既有失公平,也败坏了体育道德。某种兴奋剂的结构简式如图所示。有关该物质的说法中正确的是
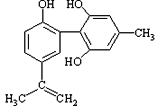
A. 该物质与苯酚属于同系物,遇FeCl3溶液呈紫色
B. 滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中存在碳碳双键
C. 1mol该物质分别与浓溴水和H2反应时最多消耗Br2和H2分别为4mol和7mol
D. 该分子中的所有碳原子不可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案中,能达到相应实验目的的是
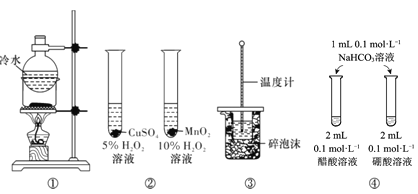
A.方案①用于分离I2和NH4Cl固体
B.方案用于比较CuSO4和MnO2的催化活性
C.方案③用于测定中和热
D.方案④用于比较醋酸和硼酸的酸性强弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com