
����Ŀ��þ���仯������;�dz��㷺��Ŀǰ������60%��þ�ǴӺ�ˮ����ȡ���Ӻ�ˮ���Ƚ���ˮ������õ�ˮ��Ũ��ˮ��Ũ��ˮ����Ҫ�ɷ����£�
���� | Na+ | Mg2+ | Cl�� | SO42�� |
Ũ��/��gL��1�� | 63.7 | 28.8 | 144.6 | 46.4 |
������Ũ��ˮ��þ��һ�ι�����������ͼ��
��ش���������
��1��Ũ��ˮ��Ҫ���е��������������ʵ���Ũ����С���� �� �����������У�����ѭ��ʹ�õ������� ��
��2���ڸù��չ����У�X�Լ��Ļ�ѧʽΪ ��
��3����һ����ˮ��Ŀ�����Ʊ�MgCl22H2O����������ˮ����Ŀ�����Ʊ����ԭ�ϣ�����MgCl26H2Oֱ�Ӽ�����ˮ���������Mg��OH��Cl�������ԭ���к���Mg��OH��Cl�����ʱMg��OH��Cl������������Mg��Ӧ��ʹ�����������MgO�ۻ�Ĥ�����͵��Ч�ʣ�����MgO�Ļ�ѧ����ʽΪ ��
��4�����Ƶ�Mg��OH��2�Ĺ�����Ũ��ˮ��������Ϊ80%����Mg��OH��2����������ˮ���Ƶõ��ԭ�ϵĹ�����þԪ�ص�������Ϊ90%����1m3Ũ��ˮ�ɵá�������ˮ����ĵ��ԭ������Ϊg��
��5����LiCl��KCl������Ϊ����ʵ�Mg��V2O5�����ս�������ij��õ�Դ���õ�ص��ܷ�ӦΪ��Mg+V2O5+2LiCl MgCl2+V2O4Li2O �õ�ص�������ӦʽΪ ��
��6��Mg�Ͻ�����Ҫ�Ĵ�����ϣ�2LiBH4/MgH2��ϵ�����ʱ�ʾ��ͼ���£��� Mg��s��+2B��s�� MgB2��s����H= �� 
���𰸡�
��1��SO42����Cl2��HCl
��2��CaCl2
��3��2Mg��OH��Cl+Mg=MgCl2+2MgO+H2��
��4��82080
��5��V2O5+2Li++2e��=V2O4?Li2O
��6����93kJ/mol
���������⣺Ũ��ˮ�����Ȼ��ƣ�����������ƣ�һ�ﵽ�����Ŀ�ģ�������ʯ�ң�������������þ����������MgCl26H2O��һ����ˮ����MgCl22H2O����ͨ��HCl�ķ�Χ�м����Ȼ�þ��Һ�õ��Ȼ�þ�����ɵõ�þ����������1���ɱ�������c��Na+��= ![]() =2.77mol/L��c��Mg2+��=
=2.77mol/L��c��Mg2+��= ![]() =1.2mol/L��c��Cl����=
=1.2mol/L��c��Cl����= ![]() =4.07mol/L��c��SO42����=
=4.07mol/L��c��SO42����= ![]() =0.48mol/L����SO42�������ʵ���Ũ����С��������������������������Ӧ�����Ȼ��⣬�Ȼ������������þ��Ӧ�Ʊ��Ȼ�þ�����ѭ������Cl2��HCl�����Դ��ǣ�SO42����Cl2��HCl����2��XΪ�Ȼ��ƣ�����������ƣ�һ�ﵽ�����Ŀ�ģ����Դ��ǣ�CaCl2����3��������֪Mg��OH��Cl������������Mg��Ӧ������MgO����Ӧ�Ļ�ѧ����ʽΪ2Mg��OH��Cl+Mg=MgCl2+2MgO+H2�������Դ��ǣ�2Mg��OH��Cl+Mg=MgCl2+2MgO+H2������4����������ݿ�֪1m3Ũ��ˮ����m��Mg2+��=1000L��28.8g/L��n��Mg2+��=
=0.48mol/L����SO42�������ʵ���Ũ����С��������������������������Ӧ�����Ȼ��⣬�Ȼ������������þ��Ӧ�Ʊ��Ȼ�þ�����ѭ������Cl2��HCl�����Դ��ǣ�SO42����Cl2��HCl����2��XΪ�Ȼ��ƣ�����������ƣ�һ�ﵽ�����Ŀ�ģ����Դ��ǣ�CaCl2����3��������֪Mg��OH��Cl������������Mg��Ӧ������MgO����Ӧ�Ļ�ѧ����ʽΪ2Mg��OH��Cl+Mg=MgCl2+2MgO+H2�������Դ��ǣ�2Mg��OH��Cl+Mg=MgCl2+2MgO+H2������4����������ݿ�֪1m3Ũ��ˮ����m��Mg2+��=1000L��28.8g/L��n��Mg2+��= ![]() mol��������Mg��OH��2�����ʵ���Ϊ
mol��������Mg��OH��2�����ʵ���Ϊ ![]() mol��80%����������ˮ����MgCl2�����ʵ���Ϊ
mol��80%����������ˮ����MgCl2�����ʵ���Ϊ ![]() ��80%��90%������Ϊ
��80%��90%������Ϊ ![]() mol��80%��90%��95g/mol=82080g�����Դ��ǣ�82080����5������������ԭ��Ӧ��V2O5����ԭ����V2O4Li2O���缫����ʽΪV2O5+2Li++2e��=V2O4Li2O�����Դ��ǣ�V2O5+2Li++2e��=V2O4Li2O����6����ͼ��֪��2LiBH4��s��+MgH2��s��=2LiH��s��+2B��s��+MgH2��s��+3H2��g����H=+200 kJmol��1�� 2LiBH4��s��+MgH2��s��=2LiBH4��s��+Mg��s����+H2��g����H=+76 kJmol��1��
mol��80%��90%��95g/mol=82080g�����Դ��ǣ�82080����5������������ԭ��Ӧ��V2O5����ԭ����V2O4Li2O���缫����ʽΪV2O5+2Li++2e��=V2O4Li2O�����Դ��ǣ�V2O5+2Li++2e��=V2O4Li2O����6����ͼ��֪��2LiBH4��s��+MgH2��s��=2LiH��s��+2B��s��+MgH2��s��+3H2��g����H=+200 kJmol��1�� 2LiBH4��s��+MgH2��s��=2LiBH4��s��+Mg��s����+H2��g����H=+76 kJmol��1��
2LiBH4��s��+MgH2��s��=2LiH��s��+MgB2��s��+4H2��g����H=+183 kJmol��1��
2LiH��s��+MgB2��s��+4H2��g��=2LiH��s��+2B��s��+MgH2��s��+3H2��g����H=+��200��183��kJmol��1��
����MgB2��s��+H2��g��=2B��s��+MgH2��s����H=+17 kJmol��1��
���ԩ��ܩ��ڵã�Mg��s��+2B��s���TMgB2��s����H=����17+76��kJmol��1=��93kJmol��1 ��
���Դ��ǣ���93kJmol��1 ��
�����㾫�������ڱ��⿼��ķ�Ӧ�Ⱥ��ʱ䣬��Ҫ�˽��ڻ�ѧ��Ӧ�зų������յ�������ͨ���з�Ӧ�Ȳ��ܵó���ȷ�𰸣�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��黯�����У���ѧ��������ȫ��ͬ���ǣ�(����)
A. HCl ��NaOHB. Na2O ��Na2O2
C. CO2�� CaOD. CaCl2�� Na2S
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ƣ�Na2S2O3���ǻ������ż���к����峣�õ�һ��ҩƷ����������ˮ�������ֽ⡣ijʵ����ģ�ҵ���ȡ��������ƣ��䷴Ӧװ�ü������Լ���ͼ��
ʵ������������Ϊ��
�ٴ�Һ©��ʹ�����������£��ʵ����ڷ�Һ©���ĵ��٣�ʹ��Ӧ������SO2����Ͼ��ȵ�ͨ��Na2S��Na2CO3�Ļ����Һ�У�ͬʱ�����綯������������ˮԡ���ȣ��С�
��ֱ�������Ļ��Dz�����ʧ����������Һ��pH�ӽ�7ʱ��ֹͣͨ��SO2���塣
��1�������A��������
��2��д��A�з�����Ӧ�Ļ�ѧ����ʽ��
��3��Ϊ�˱�֤��������ƵIJ�����ʵ����ͨ���SO2���ܹ�����ԭ������
��4��Na2S2O3���������ȼ�������Һ���ױ�Cl2������SO42���ӣ��÷�Ӧ�����ӷ���ʽΪ��
��5��Ϊ����֤������������ƹ�ҵ��Ʒ�к���̼���ƣ�ѡ����ͼװ�ý���ʵ�顣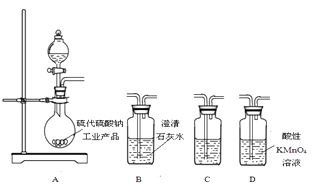
��ʵ��װ�õ�����˳������������װ�õ���ĸ���ţ���װ��C�е��Լ�Ϊ��
����֤�������к���̼���Ƶ�ʵ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��3CH4��g��+2N2��g��3C��s��+4NH3��g����H��0��700��ʱ��CH4��N2�ڲ�ͬ���ʵ���֮��[ ![]() ]ʱCH4��ƽ��ת������ͼ��ʾ������˵����ȷ���ǣ� ��
]ʱCH4��ƽ��ת������ͼ��ʾ������˵����ȷ���ǣ� �� 
A.![]() Խ��CH4��ת����Խ��
Խ��CH4��ת����Խ��
B.![]() ����ʱ�������£�NH3���������������
����ʱ�������£�NH3���������������
C.b���Ӧ��ƽ�ⳣ����a��Ĵ�
D.a���Ӧ��NH3���������ԼΪ26%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ҿ���NaClO3��ȡClO2���壬����ClO2�Ƶ�NaClO2 �� ʵ��װ����ͼ��ʾ���ش��������⣺ 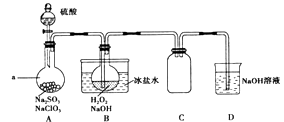
��1������a������Ϊ��װ��C�������� ��
��2����ʵ�����ʹNaClO3��������Ŀ���� ��
��3��ΪʹClO2�����ܱ����ȡ�������գ�����ʱӦע�� ��
��4��NaOH����ClO2β�����������ʵ���֮��Ϊ1��1�����������ӣ�һ��ΪClO2�� �� ����һ��Ϊ ��
��5��B�з�Ӧ�����ӷ���ʽΪ ��
��6��֤��NaClO2���������Եķ����ǣ���B����Һ���ȳ�ȥH2O2 �� ����������ţ���ͬ���ữ���ټ������飮 ��ϡHNO3��ϡH2SO4��K2SO3��Һ ��BaCl2��Һ ��FeCl2��Һ ��KSCN��Һ
��7��Ԥ��NaClO3ת��ΪNaClO2��ת����Ϊ80%����Ҫ�Ƶ�28.9g NaClO23H2O�����������144.5����������g NaClO3�����������106.5����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У��Ⱥ������Ӽ��ֺ��зǼ��Թ��ۼ�����( )
A.NaOHB.Na2O2C.BeCl2D.H2O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������жϴ������
A. �ȶ��ԣ�H2O>NH3>CH4B. ԭ�Ӱ뾶��N<O<F
C. ���ԣ�HClO4>H2SO4>H3PO4D. ���ԣ�NaOH>Mg(OH)2>Al(OH)3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͭ��ʯ����CuO��������ˮ��Cu2(OH) 2CO3 �� ������Fe2O3��FeO��SiO2�ȡ�ͭ�������������������Ԫ�ء�ij����������ͭ�����������������£�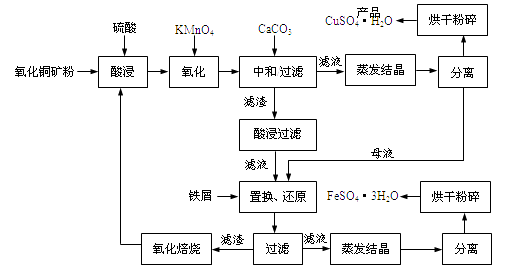
��1������ͭ��ʯ�����Ŀ����,KMnO4�������ǽ�Fe2+������Fe3+��
��2��д�����������Cu2(OH) 2CO3������Ӧ�����ӷ���ʽ ��
��3�����к�/���ˡ��м���CaCO3��Ŀ����,ʹFe3+ ˮ��ɳ�������ȥ��
��4�������жദ�漰�����ˡ���ʵ�����й�����Ҫʹ�õIJ����������ձ�����
��5��������м��������ʹĸҺ��Fe3+ת��ΪFe2+����
��6���±�Ϊ����ͭ���塰��ɷ��顱����������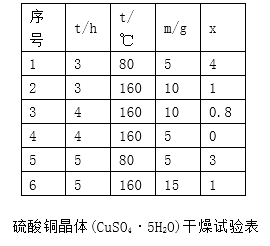
����mΪCuSO4��5H2O�����������xΪ��������þ����нᾧˮ�������ݴ˿�ȷ����CuSO4��5H2O��ˮ��������ʾ��Ʒ�����˹�������Ϊ��ָ���������¶Ⱥ�ʱ�䣩��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����17�֣��Ǽ��㶹����һ�����Ƶ���ʯ��ҩ��ϳ�·������ͼ��ʾ��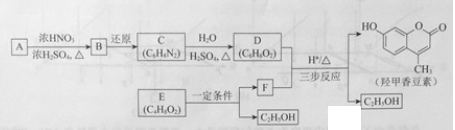


��֪�� 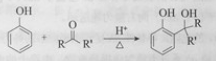
RCOOR'+R'OH ![]() RCOOR'+ R'OH��R��R'��R'����������
RCOOR'+ R'OH��R��R'��R'����������
��1��A���ڷ���������ṹ��ʽ����B�������Ĺ���������
��2��C��D�ķ�Ӧ��������
��3��E����֬�ࡣ�����Ҵ�Ϊ�л�ԭ�ϣ�ѡ�ñ�Ҫ�����Լ��ϳ�E��д���йػ�ѧ����ʽ����
��4����֪��2E ![]() F+C2H5OH��F������������
F+C2H5OH��F������������ ![]() ����
����
��5����D��FΪԭ�Ϻϳ��Ǽ��㶹�ط�Ϊ������Ӧ��д���йػ�����Ľṹ��ʽ��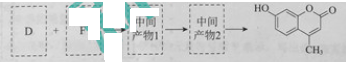
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com