
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |
| 催化剂 |
| 催化剂 |


 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:阅读理解
 (2013?河西区一模)肼(N2H4)和氨是氮的两种常见化合物,在科学技术和生产中有广泛应用.请按要求回答下列问题:
(2013?河西区一模)肼(N2H4)和氨是氮的两种常见化合物,在科学技术和生产中有广泛应用.请按要求回答下列问题:

| ||
| ||
| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
| n(NH3) |
| n(CO2) |
| n(N2) | n(H2) | n(NH3) | |
| 甲 | 1mol | 3mol | 0mol |
| 乙 | 0.5mol | 1.5mol | 1mol |
| 丙 | 0mol | 0mol | 4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
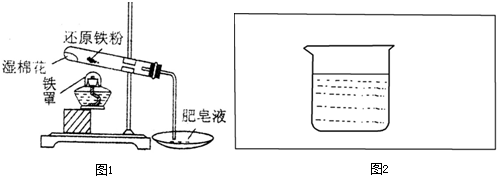
 ”表示),设计一套原电池装置,并验证有电流产生,请帮他在图2方框内补充全装置简图(要求标注正、负极及其材料和电解质溶液名称).
”表示),设计一套原电池装置,并验证有电流产生,请帮他在图2方框内补充全装置简图(要求标注正、负极及其材料和电解质溶液名称).查看答案和解析>>
科目:高中化学 来源:2016届四川省绵阳市高一上学期12月月考化学试卷(解析版) 题型:填空题
Ⅰ、物质的分离和提纯有多种方法。物质分离、提纯方案的设计在科学研究和工业生产中占有十分重要的地位。工业上冶炼铝的原料是铝土矿(主要成分是Al2O3,杂质为Fe2O3、SiO2等,已知SiO2是不溶于水的酸性氧化物,Fe2O3是不溶于水的碱性氧化物)。某研究小组设计的提纯Al2O3的方案如下:
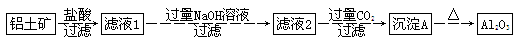
(1)写出沉淀A的化学式:___________________________________________________。
(2)加入过量的NaOH溶液,过滤后的滤液中含有的溶质有________________________。
(3)写出由沉淀A―→Al2O3的化学方程式:________________________,通入过量CO2生成沉淀A时反应的离子方程式为_______________________________________________。
Ⅱ、按照要求回答下列问题:
A、B、C、D、E是常见化合物或单质,有如下转化关系 (略去条件和副产品)。
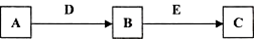
(1)若A为黄绿色气体单质,D、E为生活中常见的两种金属,其中E是一种红色光亮的物质。
① 写出向B的溶液中加入足量D的离子反应方程式_____________________________________。
②向①所得的溶液中加入NaOH溶液,并在空气中放置的现象是:_________________________,写出固体在空气中放置的化学反应方程式:__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 肼(N2H4)和氨是氮的两种常见化合物,在科学技术和生产中有广泛应用.请按要求回答下列问题:
肼(N2H4)和氨是氮的两种常见化合物,在科学技术和生产中有广泛应用.请按要求回答下列问题:
(1)N2H4中N原子核外最外层达到8电子稳定结构.写出N2H4的结构式:______.
(2)实验室用两种固体制取NH3的反应化学方程式为______.
(3)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为______.
(4)肼一空气燃料电池是一种碱性环保电池,该电池放电时,负极的反应式为______.
(5)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2]反应的化学方程式为2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(l),该反应的平衡常数和温度关系如下:
| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
①焓变△H______0(填“>”、“<”或“=”).
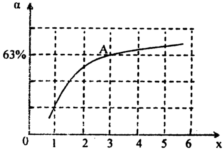
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)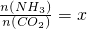 ,如图是氨碳比(x)与CO2平衡转化率(α)的关系.α随着x增大而增大的原因是______.图中A点处,NH3的平衡转化率为______.
,如图是氨碳比(x)与CO2平衡转化率(α)的关系.α随着x增大而增大的原因是______.图中A点处,NH3的平衡转化率为______.
(6)在恒温恒容密闭容器中按照甲、乙、丙三种方式分别投料,发生反应:N2(g)+3H2(g)?2NH3(g),测得甲容器中H2的平衡转化率为40%.
| n(N2) | n(H2) | n(NH3) | |
| 甲 | 1mol | 3mol | 0mol |
| 乙 | 0.5mol | 1.5mol | 1mol |
| 丙 | 0mol | 0mol | 4mol |
①判断乙容器中反应进行的方向是______(填“正向或“逆向”)移动.
②达平衡时,甲、乙、丙三容器中NH3的体积分数大小顺序为______.
查看答案和解析>>
科目:高中化学 来源:同步题 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com