
分析 1.求出标准状况下,22.4LH2的物质的量,然后根据氢气为双原子分子来分析;
2.求出24gMg的物质的量,然后根据镁变为Mg2+时失去2个电子来分析;
3.求出32gO2的物质的量,然后根据氧气为双原子分子来分析;
4.标准状况下,H2O为液态;
5.常温常压下,气体摩尔体积大于22.4L/mol;
6.钠原子中含11个电子;
7.求出NA个CO分子的物质的量,然后根据质量m=nM来计算;
8.分子个数N=nNA;
9.标准状况下,水为液态;
10.根据H原子个数守恒来分析;
11.H3O+中含10个电子;
12.氧气和臭氧均由氧原子构成.
解答 解:1.标准状况下,22.4LH2的物质的量为1mol,而氢气为双原子分子,故1mol氢气中含2NA个氢原子,故错误;
2.24gMg的物质的量为1mol,而镁变为Mg2+时失去2个电子,故1mol镁失去2NA个电子,故正确;
3.32gO2的物质的量为1mol,而氧气为双原子分子,故1mol氧气中含2NA个氧原子,故正确;
4.标准状况下,H2O为液态,故不能根据气体摩尔体积来计算其物质的量和分子个数,故错误;
5.常温常压下,气体摩尔体积大于22.4L/mol,故11.2L氮气的物质的量小于0.5mol,则分子个数小于0.5NA个,故错误;
6.钠原子中含11个电子,故1mol钠原子中含11NA个电子,故错误;
7.NA个CO分子的物质的量为1mol,故质量m=nM=1mol×28g/mol=28g,故正确;
8.分子个数N=nNA=1mol×NA/mol=NA,故正确;
9.标准状况下,水为液态,故不能根据气体摩尔体积来计算其物质的量和含有的分子个数,故错误;
10.根据H原子个数守恒可知,1mol氢气燃烧后的产物中H原子个数仍为2NA个,故正确;
11.H3O+中含10个电子,故1molH3O+中含10NA个电子,故错误;
12.氧气和臭氧均由氧原子构成,故32g混合物中含氧原子为2mol,个数为2NA个,故正确.
故选2、3、7、8、10、12.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 第一份 | 第二份 | 第三份 | |
| 样品的质量/g | 6.830 | 13.660 | 30.000 |
| 二氧化硫气体的体积/L | 0.672 | 1.344 | 2.688 |
| 硫的质量/g | 0.800 | 1.600 | 3.200 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
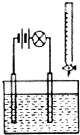 对电解质溶液的导电性进行实验,其装置如图所示.若向某一电解质溶液中逐滴加入另一溶液时,灯泡由亮变暗至熄灭,后又逐渐变亮的是( )
对电解质溶液的导电性进行实验,其装置如图所示.若向某一电解质溶液中逐滴加入另一溶液时,灯泡由亮变暗至熄灭,后又逐渐变亮的是( )| A. | 盐酸中逐滴加入NaCl溶液 | B. | 氢硫酸中逐滴加入氢氧化钠溶液 | ||
| C. | 醋酸中逐滴加氨水 | D. | 硫酸中逐滴加入氢氧化钡溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①③⑤ | C. | ③④⑥ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
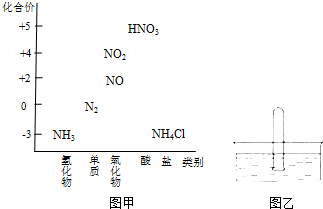 图甲为氮及其化合物的类别与化合价对应的关系图.
图甲为氮及其化合物的类别与化合价对应的关系图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com