
��ͼΪ�������ȡ����Ӧ�ĸĽ�ʵ��װ��ͼ������AΪ��֧�Թܸ��Ƴɵķ�Ӧ�����������¶˿���һС�ף�����ʯ���ޣ��ټ�����м��������
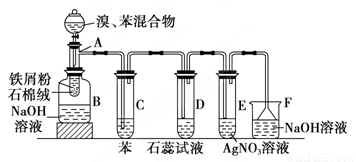
��д���пհף���ע���屽��NaOH��Һ�����Է���ˮ�ⷴӦ��
��1����Ӧ����A����μ�����ͱ��Ļ��Һ���������ھͷ�����Ӧ��д��A����������Ӧ�Ļ�ѧ����ʽ���л���д�ṹ��ʽ��_____________��
��2���Թ�C�б���������________����Ӧ��ʼ�۲�D��E�Թܣ�����������ΪD��_________ ��E�� ��
��3����Ӧ2 min��3 min����B�е�NaOH��Һ�ɹ۲쵽�������� ��
��4������������װ���У����з�������������_______������ĸ��
��5���Ľ����ʵ����ٲ�����������㣬�ɹ��ʸߣ��ڸ����������ԣ��۶Բ�Ʒ���ڹ۲���3���ŵ��⣬����һ���ŵ���_______________��
��1��2Fe+3Br2=2FeBr3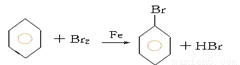
��2����ȥHBr�л��е���������D��ʯ����Һ��죬���ڵ��ܿ��а�����E�г���dz��ɫ�������ڵ��ܿ��а���������
��3������Һ�ײ�����ɫ��״Һ����֡�
��4��DEF
��5������һ���ŵ��ǣ�β�����մ�����ȫ����ֹ��Ⱦ������
����������1����Ӧ��A����μ�����???���Ļ��������ķ�Ӧ�ǣ�
2Fe+3Br2=2FeBr3 
��2����A�в�����HBr�л����������������HBr����ǿ�ᣬ����D�е�ʯ����Һ���죬HBr�ӷ����ڵ��ܿڻ��а�����������E�е������dz���dz��ɫ�������ڵ�������Ȼ���а���������
��3����Ӧһ��ʱ���������屽��������B�У������屽����ϰ������Һ����Ӧ�����屽���ܶȱ�ˮ�أ�������B�ĵײ�����������Һ�пɹ۲쵽����״Һ����֣�
��4��������֪��װ���У�DE����û�����뵽Һ���У�FΪ���õ�©���������DEF���з����������á�
��5��HBr������������Һ�ķ�Ӧ������β�����մ�����ȫ����ֹ��Ⱦ������
β�����մ�����ȫ����ֹ��Ⱦ������


 ��Ч���ܿ�ʱ��ҵϵ�д�
��Ч���ܿ�ʱ��ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014�߿���ʦ�Ƽ���ѧ������ɡ��ṹ�����ʣ������棩 ���ͣ�ѡ����
�����±�(���ֶ�����Ԫ�ص�ԭ�Ӱ뾶����Ҫ���ϼ�)��Ϣ���ж�����������ȷ����
Ԫ�ش��� | A | B | C | D | E |
ԭ�Ӱ뾶/nm | 0.186 | 0.143 | 0.089 | 0.102 | 0.074 |
��Ҫ���ϼ� | ��1 | ��3 | ��2 | ��6����2 | ��2 |
A������������Ӧˮ����ļ���A��C
B���⻯��ķе�H2D��H2E
C��������ϡ���ᷴӦ������A��B
D��C2����A�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ʦ�Ƽ���ѧ��ҵ����ͼ�����������棩 ���ͣ������
��ͭ����Ҫ�ɷ��Ƕ�������ͭ��CuFeS2������ͭ�����������պ�õ���ͭ��¯����ұ�����̵���Ҫ��Ӧ�У�
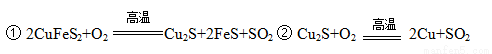
��1����������ͭҲ���Ա�ʾΪCuS��FeS��������Ԫ�صĻ��ϼ��� ��
��2����Ӧ���л�ԭ���� ��
��3��ijУѧϰС������ͭ������¯������Fe2O3��FeO��SiO2��Al2O3�ȣ��Ʊ����죬��������ʵ�顣
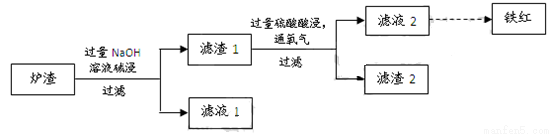
�� ¯�����ʱ��Ӧ�����ӷ���ʽ�� �� ��
�� ����1�м������Ტͨ��������ʹFeOת��ΪFe3+���÷�Ӧ�����ӷ���ʽ�� ��Ϊ������Ԫ���Ƿ�������ȫ��Ӧ���е�ʵ���ǣ�ȡ������Һ2���Թ��� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ʦ�Ƽ���ѧʵ��ר�⣨�����棩 ���ͣ�ʵ����
ij��ѧ�С���������ͼ��ʾ(���ּг�װ������ȥ)ʵ��װ�ã���̽����ʪ��Cl2��Na2CO3��Ӧ�õ��Ĺ������ʡ�
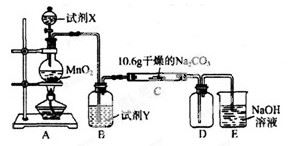
��1��д��װ��A�з�����Ӧ�����ӷ���ʽ�� ��
��2��д���Լ�Y������_____________________��
��3����֪��ͨ��һ�������������D��ֻ��һ�ֳ�����Ϊ�ƺ�ɫ�����壬��Ϊ�������������ȷ������C�к��е�����ֻ��һ�֣��Һ���NaHCO3���ֶ�C�ɷֽ��в����̽����
������������裺
����һ���������ֳɷ֣�NaHCO3��__________
��������������ֳɷ֣�NaHCO3��__________��__________��
����Ʒ���������ʵ�顣��д��ʵ�鲽���Լ�Ԥ������ͽ��ۣ��ɲ���������
��ѡʵ���Լ�������������ˮ��ϡ���ᡢBaCl2��Һ������ʯ��ˮ��AgNO3��Һ���Թܡ�С�ձ���
ʵ�鲽�� | Ԥ������ͽ��� |
����1��ȡC�е�����������Ʒ���Թ��У��μ���������ˮ�������ܽ⣬Ȼ��������Һ�ֱ�����A��B�Թ��С� |
|
����2����A�Թ��еμ�_________�� | ��������������֤�������в���̼���ƣ� ������Һ����ǣ�֤�������к���̼���ơ� |
����3����B�Թ��еμ�________�� | ����Һ����ǣ���ϲ���2�еĢ٣������һ��������ϲ���2�еĢڣ������������� |
��4����֪C����0.1 mol Cl2�μӷ�Ӧ��������һ����������֪C�з�Ӧ�Ļ�ѧ����ʽΪ ��
��5��������Na2CO3��NaHCO3��Ϊ0.1mol/L�Ļ����Һ�У�c(OH��)-c(H+)=____ ���ú�̼Ԫ�ص�����Ũ�ȱ�ʾ�����ڸ���Һ�еμ�ϡ����������ʱ����Һ�����ʵijɷ���___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ʦ�Ƽ���ѧʵ��ר�⣨�����棩 ���ͣ������
ij�о�С��ģ�ҵ������ƺ����ˮ���ⶨ������Ч�ʣ�������ͼ��ʾװ�ý���ʵ�顣��CN����Ũ��Ϊ0.2 mol��L��1�ĺ����ˮ100 mL��100 mL NaClO��Һ������������װ�â�������ƿ�У���ַ�Ӧ����Һ©������������100 mLϡH2SO4���رջ�����
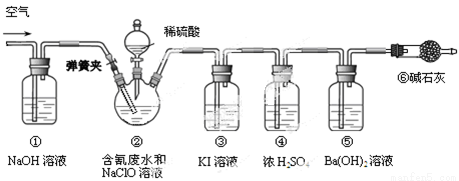
��֪װ�â��з�������Ҫ��Ӧ����Ϊ��
CN��+ ClO��=CNO��+ Cl�� 2CNO��+2H+ +3C1O��=N2��+2CO2��+3C1��+H2O
��1���ٺ͢������� ��
��2��װ�â��У���������װ�â۳�ȥ�����ʵ����ӷ���ʽΪ ��
��3����Ӧ��������ͨ�������Ŀ���� ��
��4��Ϊ�����ʵ���к����ˮ�������İٷ��ʣ���Ҫ�ⶨ ��������
��5����֪CN-�Ĵ���Ч�ʿɸߴ�90%��������CO2�ڱ�״���µ����Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ʦ�Ƽ���ѧ�غ㼰����Ũ�ȴ�С�ıȽϣ������棩 ���ͣ�ѡ����
�ڳ����£������й���Һ���������ʵ���Ũ�ȹ�ϵ��ȷ����
A��1 L 0.1 mol��L��1(NH4)2Fe(SO4)2��6H2O����Һ�У�c(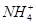 )��c(Fe2��)��c(H��)��c(OH��)��c(
)��c(Fe2��)��c(H��)��c(OH��)��c(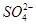 )
)
B��0.1 mol��L��1 NH4HS��Һ�У�c(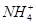 )��c(HS��)��c(H2S)��c(S2��)
)��c(HS��)��c(H2S)��c(S2��)
C��0.1 mol��L��1 pHΪ4��NaHA��Һ�У�c(HA��)>c(H2A)>c(A2��)
D����Ũ�ȵ�̼���ƺ�̼��������Һ��Ϻ����Һ�У�2c(OH��)��c(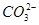 )��c(
)��c(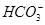 )��3c(H2CO3)��2c(H��)
)��3c(H2CO3)��2c(H��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ʦ�Ƽ���ѧ����Ӫ�����ʣ������棩 ���ͣ�ѡ����
����˵������ȷ����
A.���ۺ���ά�صķ���ʽ��Ϊ(C6H10O5)n�����ǻ�Ϊͬ���칹��
B.�Ҵ������ᶼ�dz��õ�ζƷ����Ҫ�ɷ�
C.������ϩ��ʹ������Ȼ�̼��Һ��ɫ
D.���岻��������ά��,������ά�������������ò���,�˿��Բ��Ը�����ά�ص�ʳ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ʦ�Ƽ���ѧͬ���칹����жϣ������棩 ���ͣ�ѡ����
ij�¶�ʱ�����ܱ������У�X��Y��Z��������Ũ�ȵı仯��ͼ����ʾ���������������䣬���¶ȷֱ�ΪT1��T2ʱ��Y�����������ʱ���ϵ��ͼ����ʾ�������н�����ȷ����
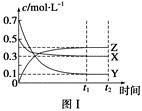
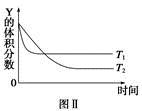
A���÷�Ӧ���Ȼ�ѧ����ʽΪX(g)��3Y(g)  2Z(g) ��H��0
2Z(g) ��H��0
B���������������䣬�����¶ȣ������淴Ӧ�ٶȾ�����X��ת���ʼ�С
C���ﵽƽ����������������䣬��С���������ƽ�����淴Ӧ�����ƶ�
D���ﵽƽ����������������䣬ͨ��ϡ�����壬ƽ��������Ӧ�����ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ʦ�Ƽ���ѧ��ѧ�����֮���������������棩 ���ͣ�ѡ����
X��Y��Z��W��R���ڶ�����Ԫ�ء���֪���Ƕ�����ϡ������Ԫ�أ�X��ԭ�Ӱ뾶���YԪ�ص�ԭ������������Ϊm������������Ϊn��ZԪ�ص�ԭ��L�������Ϊm��n��M�������m��n��WԪ����ZԪ��ͬ���壬RԪ��ԭ����YԪ��ԭ�ӵĺ��������֮��Ϊ2��1�����������������
A��X��Y�γɵ����ֻ����������������ӵĸ����Ⱦ�Ϊ1��2
B��Y���⻯���R���⻯���ȶ���Y���⻯���۷е��R���⻯���
C��Z��W��R����������Ӧˮ���������ǿ��˳��R��W��Z
D��Y�ֱ���Z��W��R������Ԫ����ɵij�����������5��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com