
����A��B��C��D���ֶ�����Ԫ�أ�����֮��Ĺ�ϵ���£�
��ԭ�Ӱ뾶��A < C < B < D ��ԭ�ӵ�������������A + C = B + D = 8
��ԭ�ӵĺ�����Ӳ�����B = C = 2A ����BԪ�ص���Ҫ���ϼۣ�������� + ����� = 2
��ش�
��1����A��B����Ԫ����ɵij������壬�����ʽΪ ��ֻ��A��B����Ԫ����ɵ��������Ӿ���Ļ��������Ϊ ���û�ѧʽ��ʾ����
��2����DԪ���γɵ����������ǿ����Һ��Ӧ�����ӷ���ʽΪ ��
��3����B��CԪ����ɵĻ�����BC3���û��������ǿ�����ԣ���ˮ��Ӧ�����������һ����ɫ���壬�����峣���������������ɫ��д���û�������ˮ��Ӧ�Ļ�ѧ����ʽ ��
��4����A��B��C����Ԫ����ɵ��Σ���������ˮ��Һ�����ԣ�д��������������������ӵ�ʵ�鷽�� ��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij��ѧ��Ӧ������ͼ��ʾ����ͼ�ó����жϣ� ��ȷ���� (����)
��ȷ���� (����)
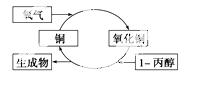
A���������DZ�ȩ�ͱ�ͪ
B��1���������˻�ԭ��Ӧ
C����Ӧ���к����ɫ����仯������
D������ܷ���ͼʾ�Ĵ�������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������(D)�������ϵ�ԭ�ϣ�������A�ϳɵõ���
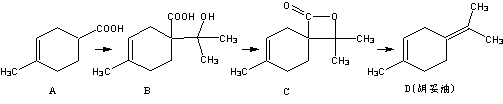
����˵����ȷ����
A�����л���A���������ϩ(C5H8)�ͱ�ϩ��(C3H4O2)���ȵõ��ģ���÷�Ӧ�ķ�Ӧ�������ڼӳɷ�Ӧ
B���л���D����������̼ԭ��һ������
C���л���C ������ͬ���칹���в����з����廯�������
D���л� ��B ���ܸ�Na��Ӧ�ų�H2�����ܸ�NaHCO3��Һ��Ӧ�ų�CO2����
��B ���ܸ�Na��Ӧ�ų�H2�����ܸ�NaHCO3��Һ��Ӧ�ų�CO2����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij��Һ��Al��Ӧ�ܷų�H2�����������ڸ���Һ��һ���ܴ����������
A��NH4����Fe2����NO3����SO42�� B��Na����K����Cl����SO42��
C��Mg2����H����Cl����NO3�� D��K����Ca2����HCO3����Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������ԭ��Ӧ�����ֻ������ͷ�Ӧ�Ĺ�ϵ����ͼ��ʾ�������л�ѧ��Ӧ����3 �������
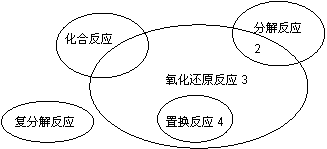 |
|
|
B��2NaHCO3 Na2CO3+H2O+CO2��
C��4Fe(OH)2+O2+2H2O 4Fe(OH)3
D��2Na2O2+2CO2 2Na2CO3+O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��NAΪ����٤��������ֵ������������ȷ���ǣ�������
| �� | A�� | ���³�ѹ�£�23g��NO2���е���ԭ����ΪNA |
| �� | B�� | ��֪ij��Ԫ�ص�һ��ԭ�ӵ�����Ϊag�����Ԫ�ص����ԭ����������ΪaNA |
| �� | C�� | ij�ܱ�����ʢ��0.1molN2��0.4molH2����һ�������³�ַ�Ӧ��ת�Ƶ��ӵ���ĿΪ0.6NA |
| �� | D�� | 80gNH4NO3�������NH4+��NA�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��һ������Fe��FeO��Fe3O4��Fe2O3�Ļ�����м���250mL 4mol/L��ϡ���ᣬǡ��ʹ�������ȫ�ܽ⣮�ų�2.24L NO����״��������������Һ�м���KSCN��Һ����Ѫ��ɫ���֣����������������ڼ����»�ԭ��ͬ�����Ļ����ܵõ��������ʵ���Ϊ��������
| �� | A�� | 0.21mol | B�� | 0.25mol | C�� | 0.45mol | D�� | 0.5mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�ö������ȡ������ƣ�Na2FeO4�������;�ˮ�������ͳ�ľ�ˮ��Cl2�Ե�ˮ���������dz�������ˮ�����¼�����ClO2��Na2FeO4��ˮ���������зֱ𱻻�ԭΪCl����Fe3+��
��1������Ե�λ���������������õ��ĵ���������ʾ����Ч�ʣ���ô��ClO2��Na2FeO4��Cl2��������ɱ����������Ч���ɴ�С��˳��������������������
��2��Na2FeO4����ˮ��ų�һ����ɫ��ζ���壬��ɱ������������ˮ�е��������ʵ�ԭ���������ӷ���ʽ��ʾΪ����
��3����ҵ��CH3OH��NaClO3Ϊԭ����������������ȡClO2��ͬʱ����CO2���壬��֪�÷�Ӧ��Ϊ�������У���һ��Ϊ2ClO3��+2Cl��+4H+=2ClO2��+Cl2��+2H2O
��д���ڶ�����Ӧ�����ӷ���ʽ��
�ڹ�ҵ����ʱ���ڷ�Ӧ���м�����Cl����������������
��4����֪����������һ�ֻ���ɫ�д̼�����ζ�����壬���۵�Ϊ��59�棬�е�Ϊ11.0�棬������ˮ����ҵ�����Գ�ʪ��KClO3�Ͳ�����60��ʱ��Ӧ�Ƶã�ClO2Ҳ���Կ����������ᣨHClO2�������ᣨHClO3���Ļ��������ijѧ������ͼ��ʾ��װ��ģ�ҵ��ȡ���ռ�ClO2������AΪClO2�ķ���װ�ã�BΪClO2������װ�ã�CΪβ������װ�ã����ʣ�
��A���ֻ�Ӧ�����¶ȿ��ƣ���ˮԡ���ȣ�װ�ã�B���ֻ�Ӧ����ʲôװ����
��C��Ӧװ���Լ�Ϊ���� C�з�����Ӧ�Ļ�ѧ����ʽΪ������
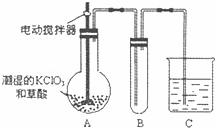
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ͼ��ʾ��ʵ��������ʯ�͵�ʵ��װ�ã�ʵ����Ҫ�ռ�60��150 ���150��300 �����֡�
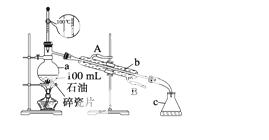
��ش��������⣺
��1������a�Ĺ�������__________������b��c�����ƣ�b________��c________��
��2��ʵ����ѡ�¶ȼ��Ǵ���ģ���ȷ��ѡ��Ӧ����_________________________��
��3��ʵ��ʱ������a�м������������Ƭ����Ŀ����________________________��
��4��ʵ��ʱ������b��ͨ����ȴˮ����ָ����ȴˮ������______________ _____________��
_____________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com