
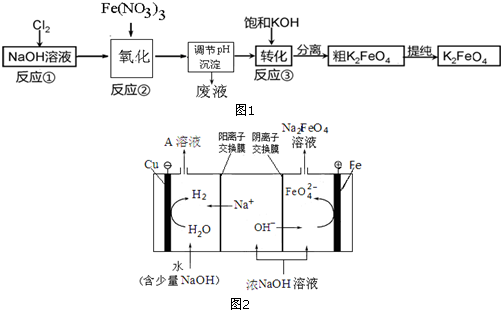
分析 (1)三价铁离子水解产生氢氧化铁胶体,胶体表面积大,吸附能力强,达到净水目的;
(2)①氯气与氢氧化钠反应产生强氧化剂次氯酸钠,硝酸铁水解产生氢氧化铁胶体,次氯酸钠将氢氧化铁氧化成高铁酸钠,据此写出氧化过程的离子方程式;已知高铁酸盐热稳定性差,在实际生产中一般控制反应温度30℃以下,其原因是防止生成的高铁酸钠发生分解;
②加入浓KOH溶液可析出高铁酸钾(K2FeO4),说明该温度下,高铁酸钾的溶解度比高铁酸钠的溶解度小;
③洗涤滤渣的方法是,将滤渣放在过滤装置中,用玻璃棒将蒸馏水引流至过滤装置中,让蒸馏水浸没沉淀,使水自然流下,重复操作2~3 次;
④Cl2生成ClO-、ClO3-化合价升高,是被氧化的过程,而Cl2生成NaCl是化合价降低被还原的过程,氧化还原反应中氧化剂和还原剂之间得失电子数目相等,据ClO-与ClO3-的物质的量浓度之比可计算出失去电子的总物质的量,进而可计算得到电子的总物质的量;再根据氯元素被还原生成KCl的化合价变化为1计算出被还原的氯元素的物质的量,最后计算出被还原的氯元素和被氧化的氯元素的物质的量之比;
(3)依据阳极是铁,故阳极上铁放电生成FeO42-结合碱性环境来写出电极方程式;根据OH-在阳极被消耗,而在阴极会生成来分析.
解答 解:(1)三价铁离子水解产生氢氧化铁胶体,离子方程式为:Fe3++3H2O?Fe(OH)3(胶体)+3H+,胶体表面积大,吸附能力强,达到净水目的,
故答案为:Fe3++3H2O?Fe(OH)3(胶体)+3H+;
(2)①氯气与氢氧化钠反应产生强氧化剂次氯酸钠,硝酸铁水解产生氢氧化铁胶体,次氯酸钠将氢氧化铁氧化成高铁酸钠,离子方程式为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;已知高铁酸盐热稳定性差,在实际生产中一般控制反应温度30℃以下,其原因是防止生成的高铁酸钠发生分解,
故答案为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;防止生成的高铁酸钠发生分解;
②加入浓KOH溶液可析出高铁酸钾(K2FeO4),说明该温度下,高铁酸钾的溶解度比高铁酸钠的溶解度小,
故答案为:该温度下,高铁酸钾的溶解度比高铁酸钠的溶解度小;
③洗涤滤渣的方法是,将滤渣放在过滤装置中,用玻璃棒将蒸馏水引流至过滤装置中,让蒸馏水浸没沉淀,使水自然流下,重复操作2~3 次,
故答案为:用玻璃棒将蒸馏水引流至过滤装置中,让蒸馏水浸没沉淀,使水自然流下,重复操作2~3 次;
④Cl2生成ClO-与ClO3-是被氧化的过程,化合价分别由0价升高为+1价和+5价,
经测定ClO-和ClO3-物质的量之比为1:2,
则可设ClO-为1mol,ClO3-为2mol,被氧化的氯元素的物质的量为:1mol+2mol=3mol,
根据化合价变化可知,反应中失去电子的总物质的量为:1mol×(1-0)+2mol×(5-0)=11mol,
氧化还原反应中得失电子数目一定相等,则该反应中失去电子的物质的量也是11mol,
Cl2生成KCl是被还原的过程,化合价由0价降低为-1价,
则被还原的Cl的物质的量为:$\frac{11mol}{1-0}$=11mol,
所以被还原的氯元素和被氧化的氯元素的物质的量之比为11mol:3mol=11:3,
故答案为:11:3;
(3)阳极是铁,故阳极上铁放电生成FeO42-,由于是碱性环境,故电极方程式为:Fe+8OH--6e-=FeO42-+4H2O,
在电解时,水电离的H+在阴极放电:2H++2e-=H2↑,c(OH-)增大,Na+通过阳离子交换膜进入阴极区,使阴极区c(NaOH)增大,故NaOH可以循环使用,
故答案为:Fe+8OH--6e-=FeO42-+4H2O;NaOH溶液.
点评 本题考查了三价铁离子与Na2FeO4的净水原理,涉及难溶电解质的计算、氧化还原反应方程的书写、计算、电极反应的书写,综合性强,有一定难度,Na2FeO4的净水是常考点,应注意归纳总结.


科目:高中化学 来源: 题型:选择题
| A. | H2SO4是酸,因为H2SO4中含有氢元素 | |
| B. | 豆浆是胶体,因为其分散质粒子直径在>1nm | |
| C. | 分子、原子、电子、质子、沙子中,沙子不适宜用物质的量描述,因为其是微观微粒 | |
| D. | 氧化铝是碱性氧化物,因为铝是金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验内容 | 实验目的 |
| A | 在碘水中加入约1mL四氯化碳,振荡试管,观察碘被四氯化碳萃取,再向试管里加入1mL浓KI水溶液,振荡试管,溶液紫色变浅 | 证明物质的溶解性规律--“相似相溶” |
| B | 取两只试管,分别加入4mL0.01mol/L KMnO4酸性溶液,然后向一只试管中加入0.1mol/LH2C2O4溶液2mL,向另一只试管中加入0.1mol/LH2C2O4溶液4mL,记录褪色时间 | 证明草酸浓度越大反应速率越快 |
| C | 分别向2mL甲苯、2mL苯、2mL正己烷中加入3滴酸性高锰酸钾溶液,振荡.甲苯中酸性高锰酸钾溶液褪色,而苯、正己烷中酸性高锰酸钾溶液不褪色 | 证明与苯环相连的甲基易被氧化 |
| D | 将反应产生的气体依次通入盛有NaOH溶液、品红溶液及酸性KMnO4溶液的试管,品红不褪色,酸性KMnO4溶液褪色 | 证明乙醇与浓硫酸混合加热可得乙烯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| 1 | Mg、Al | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
| 4 | Mg、Al | 氢氧化钠溶液 | 偏向Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | H2 | CO2 | CH3 OH | H2 O |
| 浓度(mol/L) | 0.2 | 0.2 | 0.4 | 0.4 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com