
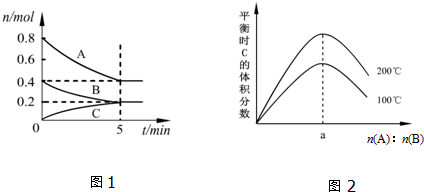
| A�� | 200��ʱ����Ӧ�ӿ�ʼ��ƽ���ƽ������v��B��=0.04 mol•L-1•min-1 | |
| B�� | ͼ2��֪��ӦxA��g��+yB��g��?zC��g���ġ�H��0����a=2 | |
| C�� | ����ͼ1��ʾ��ƽ��״̬�£�������ϵ�г���He����ʱv����v�� | |
| D�� | 200��ʱ���������г���1.6molA��0.8molB���ﵽƽ��ʱ��A��ת���ʴ���50% |
���� A����ͼ���֪��200��ʱƽ��ʱ��B�����ʵ����仯��Ϊ0.4mol-0.2mol=0.2mol������v=$\frac{\frac{��n}{V}}{��t}$����v��B����
B����ͼ���֪��n��A����n��B��һ��ʱ���¶�Խ��ƽ��ʱC���������Խ��˵�������¶�ƽ��������Ӧ�ƶ����ݴ��жϷ�Ӧ��ЧӦ��
��һ�����¶���ֻҪA��B��ʼ���ʵ���֮�ȸպõ���ƽ�⻯ѧ����ʽ��ѧ������֮�ȣ�ƽ��ʱ������C����������������ͼ���ж�200��ʱA��B����ʼ���ʵ������ݴ˼���a��ֵ��
C�����º��������£�ͨ�뺤����Ӧ������Ũ�Ȳ��䣬ƽ�ⲻ�ƣ�
D����ͼ1��֪���ﵽƽ��ʱ��A��ת����Ϊ50%��200��ʱ���������г���1.6mol A ��0.8 mol B�ﵽƽ���ЧΪ��ԭƽ�����������ѹǿ������ͼ����A��B��C�����ʵ����仯��֮�ȵ��ڻ�ѧ������֮��ȷ��x��y��z���ݴ��ж�����ѹǿƽ���ƶ�����
��� �⣺A����ͼ���֪��200��ʱ5min�ﵽƽ�⣬ƽ��ʱB�����ʵ����仯��Ϊ0.4mol-0.2mol=0.2mol����v��B��=$\frac{\frac{0.2mol}{2L}}{5min}$=0.02 mol•L-1•min-1����A����
B����ͼ���֪��n��A����n��B��һ��ʱ���¶�Խ��ƽ��ʱC���������Խ��˵�������¶�ƽ��������Ӧ�ƶ��������¶�ƽ�������ȷ�Ӧ�ƶ���������ӦΪ���ȷ�Ӧ������H��0��ͼ���֪��200��ʱƽ��ʱ��A�����ʵ����仯��Ϊ0.8mol-0.4mol=0.4mol��B�����ʵ����仯��Ϊ0.2mol����һ�����¶���ֻҪA��B��ʼ���ʵ���֮�ȸպõ���ƽ�⻯ѧ����ʽ��ѧ������֮�ȣ�ƽ��ʱ������C��������������A��B����ʼ���ʵ���֮��=0.4mol��0.2mol=2����a=2����B��ȷ��
C�����º��������£�ͨ�뺤������Ӧ��������ֵ�Ũ�Ȳ��䣬ƽ�ⲻ�ƶ�����v������=v���棩����C����
D����ͼ���֪��200��ʱƽ��ʱ��A��B��C�����ʵ����仯���ֱ�Ϊ0.4mol��0.2mol��0.2mol�����ʵ���֮�ȵ��ڻ�ѧ������֮�ȣ���x��y��z=0.4mol��0.2mol��0.2mol=2��1��1���ﵽƽ��ʱA��ת����Ϊ$\frac{0.8mol-0.4mol}{0.8mol}$=50%��200��ʱ���������г���1.6mol A ��0.8 mol B�ﵽƽ���ЧΪ��ԭƽ�����������ѹǿ��ƽ��������Ӧ�ƶ����ʴﵽƽ��ʱA��ת���ʴ���50%����D��ȷ��
��ѡBD��
���� ���⿼�黯ѧƽ��ͼ��Ӧ���ʼ��㡢Ӱ�컯ѧƽ������ء���ѧƽ���йؼ���ȣ��Ѷ��еȣ�ע��Cѡ��������ϡ������Ի�ѧƽ���ƶ���Ӱ�죮


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ֻ�Т� | B�� | ֻ�Тڢ� | C�� | ֻ�Т٢� | D�� | ȫ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | -������Fe�뺬1molHNO3����ϡ����ǡ�÷�Ӧ������ԭ�ĵ�ԭ����С��NA | |
| B�� | 1mol A1Cl3������ʱ��������Ϊ0.4NA | |
| C�� | ���³�ѹ�£���������S02��S2������ͬ�ķ����� | |
| D�� | 125g CuS04•5H20 Ʒ���к���0.5NA��Cu2+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �Ҵ������DZ��㷺ʹ�õ��������ȼ�ϣ���ҵ�����Ҵ���һ�ַ�Ӧԭ��Ϊ��
�Ҵ������DZ��㷺ʹ�õ��������ȼ�ϣ���ҵ�����Ҵ���һ�ַ�Ӧԭ��Ϊ��| �¶�/�� | 800 | 1000 | 1200 | 1400 |
| ƽ�ⳣ�� | 0.45 | 1.92 | 276.5 | 1771.5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ʳ�׳�ȥůˮƿ�еı���ˮ�� | B�� | ʯ�͵ķ����ú�ĸ��� | ||
| C�� | �ö������ȣ�ClO2��Ϊ����ˮ���� | D�� | Һ��������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com