
【题目】下列有机物的命名正确的是
A.3,3-二甲基-4-乙基戊烷B.3,3,4-三甲基己烷
C.3,4,4-三甲基己烷D.2,3-三甲基己烷
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案科目:高中化学 来源: 题型:
【题目】下列叙述错误的是
A. 淀粉、油脂、蛋白质都能水解,但水解产物不同
B. 乙酸和乙酸乙酯可用Na2CO3溶液加以区别
C. 煤油可由石油分馏获得,可用作燃料和保存少量金属钠
D. 乙烯和苯都能使溴水褪色,褪色的原因相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钡是白色的晶体,易溶于水,微溶于盐酸和硝酸,难溶于乙醇和乙醚,易吸湿,需密封保存。工业上制备BaCl2·2H2O有如下两种途径:
途径1:以重晶石(主要成分BaSO4)为原料,流程如下:

(1)写出“溶解”时反应的化学方程式方程式:________________________。
(2)“高温焙烧”时必须加入过量的炭,同时还要通入空气,其目的是_____________。
(3)结晶得到的晶体,需用乙醇洗涤的理由是_______________________。
途径2:以毒重石(主要成分BaCO3,含CaCO3、MgCO3、Fe2O3、SiO2等杂质)为原料,流程如下:

已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9,Ksp[Mg(OH)2]=1.8×10-11。
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.7 |
(4)滤渣I的成分为________(填化学式)。
(5)滤渣II中含_________(填化学式)。过滤析出后,滤液中含有的Mg2+浓度为_______。
(6)加入H2C2O4时应避免过量,其原因是为了防止生成______(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不符合第ⅦA族元素性质特征的是( )
A. 从上到下元素的非金属性增强 B. 易形成-1价离子
C. 最高价氧化物的水化物显酸性(氟除外) D. 从上到下氢化物的稳定性依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.芦笋中的天冬酰胺(结构如下图)和微量元素硒、铬、锰等,具有提高身体免疫力的功效。

(1)硒、铬、锰元素中,________(填元素符号)元素基态原子核外未成对电子数最多。
(2)天冬酰胺中碳原子的杂化轨道类型有________种。
(3)已知NN的键能为942 kJ·mol-1,N-N单键的键能为247 kJ·mol-1,则N2中的________
键稳定(填“σ”或“π”)。
Ⅱ.胆矾CuSO45H2O可写成[Cu(H2O)4]SO4 H2O,其结构示意图如下:

(4)下列说法正确的是_______(填字母)。
A.胆矾所含元素中,H、O、S的半径及电负性依次增大
B.在上述结构示意图中,存在配位键、共价键和离子键
C.胆矾是分子晶体,分子间存在氢键
D.加热条件下胆矾中的水会在相同温度下一同失去
(5)往硫酸铜溶液中加入过量氨水,溶液变为深蓝色,写出所发生反应的离子方程式__________________________;已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(18分)Na2S2O3是重要的化工原料,易溶于水。在中性或碱性环境中稳定。
I.制备Na2S2O35H2O
反应原理:Na2SO3(aq)+S(s)![]() Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取15g Na2SO3加入圆底烧瓶中,再加入80ml蒸馏水。另取5g研细的硫粉,用3ml 乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分加持装置略去),水浴加热,微沸60分钟。

③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O35H2O,经过滤,洗涤,干燥,得到产品。
回答问题:
(1)硫粉在反应前用乙醇润湿的目的是 。
(2)仪器a的名称是 ,其作用是 。
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是 ,检验是否存在该杂质的方法是 。
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子方程式表示其原因:
。
II.测定产品纯度
准确称取Wg产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000 molL1碘的标准溶液滴定。
反应原理为:2S2O32+I2=S4O62-+2I
(5)滴定至终点时,溶液颜色的变化: 。
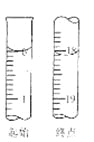
(6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为 mL。产品的纯度为(设Na2S2O35H2O相对分子质量为M) 。
III.Na2S2O3的应用
(7)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42,常用作脱氧剂,该反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
扁桃酸衍生物是重要的医药中间体,以A和B 为原料合成扁桃酸衍生物F路线如图:

图1
(1)A的分子式为C2H2O3,可发生银镜反应,且具有酸性,A所含官能团名称为_______________,写出A+B→C的化学反应方程式为_____________________________;
(2)C( )中①、②、③3个-OH的酸性由强到弱的顺序是_______________;
)中①、②、③3个-OH的酸性由强到弱的顺序是_______________;
(3)E是由2分子C生成的含有3个六元环的化合物,E分子中不同化学环境的氢原子有____________种。
(4)D→F的反应类型是_____________,1mol F在一定条件下与足量NaOH溶液反应,最多消耗NaOH的物质的量为__________mol。
(5)写出符合下列条件的F的所有同分异构体(不考虑立体异构)的结构简式:_______________。
①属于一元酸类化合物
②苯环上只有2个取代基且处于对位,其中一个是羟基
(6)已知:R-CH2-COOH![]()

A有多种合成方法,写出由乙酸合成A的路线流程图(其他原料任选),合成路线流程图示例如下:
H2C=CH2![]() CH3CH2OH
CH3CH2OH![]() CH3COOC2H5_______________________________。
CH3COOC2H5_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 原电池是把电能转变成化学能的装置
B. 原电池中电子流出的一极是正极,发生氧化反应
C. 原电池两极均发生氧化反应和还原反应
D. 原电池内部的阳离子向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.用于提纯或分离物质的常见方法有:A、萃取 B、加热分解 C、结晶 D、分液 E、蒸馏 F、过滤等,请将提纯或分离的方法填在相应的横线上(填写序号)。
(1)硝酸钾溶液中混有少量氯化钠 __________________;
(2)氧化钙中混有少量的碳酸钙 ____________________;
(3)分离碳酸钙和水 ______________________________;
(4)分离植物油和水 ______________________________;
(5)分离乙酸(沸点118℃)和乙酸乙酯(沸点77.1℃)的混合液(两者互溶)_________。
Ⅱ.如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

(1)从氯化钾溶液中得到氯化钾固体,选择装置________(填代表装置图的字母,下同);除去自来水中的Cl等杂质,选择装置________。
(2)从碘水中分离出I2,选择装置________,该分离方法的名称为________。
(3)装置A中①的名称是________,进水的方向是从_____口(填“上”或“下”)进水。装置B在分液时为使液体顺利滴下,除打开漏斗下端的旋塞外,还应进行的具体操作是________________。
(4)粗盐中含Ca2+、Mg2+、Fe3+、![]() 等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:①加入过量的Na2CO3溶液 ②加入过量的BaCl2溶液 ③过滤 ④加入过量的NaOH溶液 ⑤溶解 ⑥加盐酸调节溶液的pH等于7 ⑦蒸发
等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:①加入过量的Na2CO3溶液 ②加入过量的BaCl2溶液 ③过滤 ④加入过量的NaOH溶液 ⑤溶解 ⑥加盐酸调节溶液的pH等于7 ⑦蒸发
操作顺序合理的是_________(填字母)。
a.⑤②④①③⑥⑦ b.⑤①②④③⑥⑦
c.⑤②①④⑥③⑦ d.⑤④②①③⑥⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com