
| A. | 质量数是3 | B. | 质子数是3 | C. | 中子数是1 | D. | 电子数是2 |
科目:高中化学 来源: 题型:选择题
| A. | 3:1 | B. | 2:1 | C. | 1:1 | D. | 1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.12g | B. | 3.9g | C. | 0.78g | D. | 2.34g |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
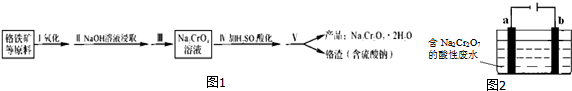
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | 由蛋白质得到氨基酸 由淀粉得到葡萄糖 | 均发生了水解反应 |
| B | CH3CH3+Cl2$\stackrel{光}{→}$CH3CH2Cl+HCl CH2=CH2+HCl→CH3CH2Cl | 均为取代反应 |
| C | 2Na2O2+2H2O═4NaOH+O2↑ Cl2+H2O═HCl+HClO | 均为水作还原剂的氧化还原反应 |
| D | Cl2+2Br-═2Cl-+Br2 Zn+Cu2+═Zn2++Cu | 均为单质被还原的置换反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2n | B. | 2n+2 | C. | 2n+10 | D. | n+2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
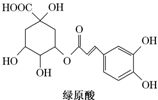 绿原酸是一种有降压作用的药物,可由咖啡酸(一种芳香酸)与奎尼酸通过酯化反应合成.下列说法正确的是( )
绿原酸是一种有降压作用的药物,可由咖啡酸(一种芳香酸)与奎尼酸通过酯化反应合成.下列说法正确的是( )| A. | 奎尼酸分子式为C7H12O6 | |
| B. | 绿原酸能发生取代、加成、消去和缩聚反应 | |
| C. | 1mol奎尼酸与NaOH溶液反应,最多消耗5mol NaOH | |
| D. | 咖啡酸和奎尼酸都能与FeCl3溶液发生显色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液与氢氧化钠溶液反应:CH3COOH+OH-═CH3COO-+H2O | |
| B. | 碳酸氢钠与盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| C. | 铁与稀硫酸反应:Fe+2H+═Fe3++H2↑ | |
| D. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
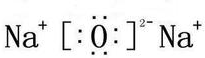 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com