
【题目】下图是元素周期表的一部分,表中的①—⑩中元素,用化学用语填空回答:
族 周期 | I A | IIA | IIIA | ⅣA | VA | ⅥA | ⅦA | 0 |
二 | ① | ② | ③ | |||||
三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
四 | ⑨ | ⑩ |
(1)在这些元素中,⑩最高价氧化物的水化物为__________。
(2)写出①的最高价氧化物和②的单质的电子式_________,________。
(3)用电子式表示③与④形成化合物的过程______________________。
(4)①的单质和⑥的氧化物反应的化学方程式______________________。
(5)写出⑤的单质与氢氧化钠反应的化学方程式:________________________写出⑤的氢氧化物与氢氧化钠溶液反应的离子方程式:_____________________。
(6)已知拆开l mol C—H键、l mol O=O键、l molC=O键、l mol H—O键分别需要吸收的能量为414kJ、498kJ、728kJ、464kJ。则l mol甲烷完全燃烧放出
【答案】HBrO4 ![]()
![]()
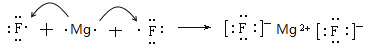 2C+SiO2
2C+SiO2![]() Si+2CO↑ 2Al+2H2O+2NaOH=2NaAlO2+3H2↑ Al(OH)3+OH-=AlO2-+2H2O 660
Si+2CO↑ 2Al+2H2O+2NaOH=2NaAlO2+3H2↑ Al(OH)3+OH-=AlO2-+2H2O 660
【解析】
由元素在周期表中位置,可知①为C、②为N、③为F、④为Mg、⑤为Al、⑥为Si、⑦为Cl、⑧为Ar,⑨为K、⑩为Br,结合元素周期律进行解答。
由元素在周期表中位置,可知①为C、②为N、③为F、④为Mg、⑤为Al、⑥为Si、⑦为Cl、⑧为Ar,⑨为K、⑩为Br。则
(1)⑩是Br元素,最高价氧化物的水化物为HBrO4,故答案为:HBrO4;
(2)①的最高价氧化物是CO2,电子式为![]() ,②的单质为N2,电子式为
,②的单质为N2,电子式为![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;
(3)③与④形成化合物是MgF2,属于离子化合物,Mg失去2个电子成为镁离子,F得到1个电子成为氟离子,用电子式表示其形成过程是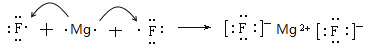 ,故答案为:
,故答案为: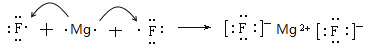 ;
;
(4)①的单质和⑥的氧化物反应即C与二氧化硅高温下发生置换反应,化学方程式为2C+SiO2![]() Si+2CO↑,故答案为:2C+SiO2
Si+2CO↑,故答案为:2C+SiO2![]() Si+2CO↑。
Si+2CO↑。
(5)⑤是Al,与氢氧化钠反应的化学方程式为2Al+2H2O+2NaOH=2NaAlO2+3H2↑;氢氧化铝与氢氧化钠溶液反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,故答案为:2Al+2H2O+2NaOH=2NaAlO2+3H2↑;Al(OH)3+OH-=AlO2-+2H2O;
(6)甲烷与氧气燃烧的化学方程式为CH4+2O2![]() CO2+2H2O,根据反应热与化学键键能的关系,△H=(4×414+2×498-2×728-2×2×464)kJ/mol=-660kJ/mol,所以1mol甲烷完全燃烧放出660kJ的热量,故答案为:660。
CO2+2H2O,根据反应热与化学键键能的关系,△H=(4×414+2×498-2×728-2×2×464)kJ/mol=-660kJ/mol,所以1mol甲烷完全燃烧放出660kJ的热量,故答案为:660。


科目:高中化学 来源: 题型:
【题目】下列有关试剂的保存方法,正确的是( )
A. 少量金属钠密封保存在水中
B. 新制的氯水通常保存在无色试剂瓶中
C. 氢氧化钠溶液保存在有玻璃塞的玻璃试剂瓶中
D. 氢氟酸保存在塑料瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学兴趣小组对某品牌牙膏中的摩擦剂成分及其含量进行以下探究:查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体产生。
Ⅰ.摩擦剂中氢氧化铝的定性检验
取适量牙膏样品,加水充足搅拌、过滤。
(1)往滤渣中加入过量 NaOH溶液,过滤。氢氧化铝与NaOH溶液反应的离子方程式是_______。
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸。观察的现象是______。
Ⅱ.牙膏样品中碳酸钙的定量测定
利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO![]() 沉淀质量,以确定碳酸钙的质量分数。
沉淀质量,以确定碳酸钙的质量分数。

依据实验过程回答下列问题:
(3)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有:________
(4)C中反应生成BaCO3的化学方程式是__________________。
(5)下列各项措施中,不能提高测定准确度的是_________(填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体
b.滴加盐酸不宜过快
c.在A-B之间增添盛有浓硫酸的洗气装置
d.在B-C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(6)实验中准确称取8.00 g样品三份,进行三次测定,测得BaCO3平均质量为3.94 g。则样品中碳酸钙的质量分数为__________。
(7)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过溶解、过滤、蒸发等操作,可将下列各组固体混合物分离的是( )
A. 硝酸钠和氢氧化钠 B. 二氧化锰和氧化铜
C. 氯化钾和二氧化锰 D. 碳酸钾和氯化钙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,反应A2(g)+B2(g)![]() 2AB(g)达到平衡的标志是( )
2AB(g)达到平衡的标志是( )
A. 单位时间内生成n molA2同时生成n molAB
B. 容器内的总物质的量不随时间变化
C. 单位时间内生成2n molAB的同时生成n molB2
D. 单位时间内生成n molA2的同时生成n molB2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】树立健康生活理念,正确认识和使用药物。下列说法错误的是( )
A.阿司匹林(aspirin)是一种解热镇痛药物
B.非处方药OTC安全系数大,可以长期大量服用
C.常用的抗酸药是氢氧化铝复方制剂
D.吃药期间不宜喝茶,更不宜用茶水服药
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器中进行反应C(s)+H2O(g)![]() CO(g)+H2(g)△H>0,测得c(H2O)随反应时间(t)的变化如图。下列判断正确的是
CO(g)+H2(g)△H>0,测得c(H2O)随反应时间(t)的变化如图。下列判断正确的是

A. 5min时该反应的K值一定小于12 min时的K值
B. 0~5min内,v (H2)=0.05mol/(Lmin)
C. 10 min时,改变的外界条件可能是减小压强
D. 该反应混合气体的平均相对分子质量:5min时小于12 min 时的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列自然资源的开发利用中,不涉及化学变化的是:
①石油的分馏;②煤的干馏;③将石油催化裂解生产乙烯;④用铝热反应焊接钢轨;⑤用乙烯制取聚乙烯;⑥用铁矿石冶炼铁;⑦乙烯做植物生长调节剂和果实催熟剂;⑧用蒸馏法从海水制取淡水;⑨用食醋清除暖水瓶中的水垢;⑩将干冰放在通风处自然升华
A. ①②③④ B. ①②⑤⑦ C. ①⑧⑩ D. ①②⑥⑨ ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将200mLH2SO4和Fe2(SO4)3的混合溶液分成两等份。向其中一份中加入足量铁粉,充分反应后测的固体质量减少4.48g;向另一份中加入足量BaCl2溶液,经过滤、洗涤、干燥、称量,得到46.6g白色沉淀。请计算:
(1)原溶液中c(SO42-)=______;
(2)原溶液中H2SO4和Fe2(SO4)3的物质的量浓度之比为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com