
实验室需480 mL 1.0 mol/L的NaOH溶液,假如其他操作均是准确无误的,下列情况会引起配制溶液的浓度偏高的是
A.称取氢氧化钠20.0 g
B.定容时俯视观察刻度线
C.移液时,对用于溶解氢氧化钠的烧杯没有进行冲洗
D.移液用玻璃棒引流时,玻璃棒下端靠在容量瓶刻度线上方
科目:高中化学 来源:2015-2016学年湖南省高二上学期期中(理)化学试卷(解析版) 题型:选择题
1840年,俄国化学家盖斯(G·H·Hess)从大量的实验事实中总结出了盖斯定律。盖斯定律在生产和科学研究中有很重要的意义,有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。已知3.6 g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出X kJ热量。已知单质碳的燃烧热为Y kJ/mol,则1 mol C与O2反应生成CO的反应热△H为
A.-Y kJ/mol B.-(5X-0.5Y) kJ/mol
C.-(10X-Y) kJ/mol D.+(10X-Y) kJ/mol
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省金兰教育合作组织高一上学期期中联考化学试卷(解析版) 题型:选择题
下列混合物的分离方法不正确的是
A.泥沙和食盐(溶解,过滤) B.汽油和水(分液)
C.KNO3和KCl(降温结晶) D.乙醇和水(分液)
查看答案和解析>>
科目:高中化学 来源:2016届广西省钦州市钦南区高三上学期期中质量调研测试化学试卷(解析版) 题型:选择题
茶叶中铁元素的检验可经过以下四个步骤完成,各步骤中选用的实验用品正确且完整是
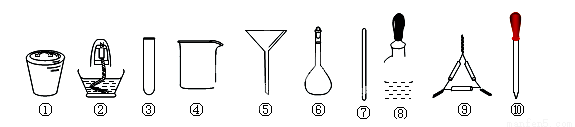
A.将茶叶灼烧灰化,选用①、②
B.用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦
C.过滤得到的滤液,选用④、⑤
D.检验滤液中的Fe3+,选用③、⑧、⑩
查看答案和解析>>
科目:高中化学 来源:2016届广西省钦州市钦南区高三上学期期中质量调研测试化学试卷(解析版) 题型:选择题
下列对于某些离子的检验及结论中一定正确的
A.加入稀盐酸产生无色的气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32-
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42-
C.加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH4+
D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
查看答案和解析>>
科目:高中化学 来源:2016届河南省南阳市高三上学期期中质量评估化学试卷(解析版) 题型:填空题
铈、铬、钛、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用。
(1)二氧化铈(CeO2)在平板电视显示屏中有着重要应用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,CeO2在该反应中作__________剂。
(2)自然界Cr主要以+3价和+6价存在。+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬。完成并配平下列离子方程式:
____Cr2O72-+___SO32-+___ =___Cr3++___SO42-+_______H2O
=___Cr3++___SO42-+_______H2O
(3)钛(Ti)被誉为“二十一世纪的金属”,工业上在550℃时用钠与四氯化钛反应可制得钛,该反应的化学方程式是____ 。
(4)NiSO4·xH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得。操作步骤如下:
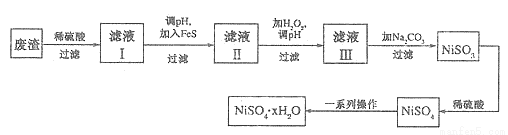
①向滤液I中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为_____________。
②对滤液Ⅱ先加H2O2再调pH,调pH的目的是_____________。
③滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是__________。
④为测定NiSO4·xH2O晶体中x的值,称取26.3g晶体加热至完全失去结晶水,剩余固体15.5g,则x的值等于__________ 。
查看答案和解析>>
科目:高中化学 来源:2016届河南省南阳市高三上学期期中质量评估化学试卷(解析版) 题型:选择题
据最新报道,科学家发现了如下反应:O2+PtF6 = O2(PtF6),已知O2(PtF6)为离子化合物,其中Pt为+5价,对于此反应,下列叙述正确的是
A.在此反应中,每生成lmolO2(PtF6),则转移1mol电子
B.在此反应中,O2是氧化剂,PtF6是还原剂
C.O2(PtF6)中氧元素的化合价是+1价
D. O2(PtF6)中仅存在离子键不存在共价键
查看答案和解析>>
科目:高中化学 来源:2016届湖北省松滋市高三上学期期中测试化学试卷(解析版) 题型:选择题
已知钡的活动性处于钾和钠之间,则下述说法中可能实现的是
A.钡可从氯化钾溶液中置换出钾
B.钡可从冷水中置换出氢气
C.钡可从氯化钠溶液中置换出钠
D.在溶液中钡离子可氧化金属锌,使之成为锌离子
查看答案和解析>>
科目:高中化学 来源:2016届江苏省苏北四市高三上学期期中质量抽测化学试卷(解析版) 题型:填空题
葡萄酒常用Na2S2O5做抗氧化剂。
(1)1.90g Na2S2O5最多能还原 mLO2(标准状况)。
(2)0.5mol Na2S2O5溶解于水配成1L溶液,该溶液pH=4.5。溶液中部分微粒浓度随溶液酸碱性变化如图所示。

写出Na2S2O5溶解于水的化学方程式 ;当溶液pH小于1后,溶液中H2SO3的浓度变小,其原因可能是 。
已知:Ksp[BaSO4]=1×10-10,Ksp[BaSO3]=5×10-7。把部分被空气氧化的该溶液pH调为10,向溶液中滴加BaCl2使SO42-沉淀完全[c(SO42-)≤1×10-5mol·L-1],此时溶液中c(SO32-)≤ mol·L-1。
(3)葡萄酒样品中抗氧化剂的残留量测定(已知: SO2+I2+2H2O=H2SO4+2HI):准确量取100.00mL葡萄酒样品,加酸蒸馏出抗氧化剂成分。取馏分于锥形瓶中,滴加少量淀粉溶液,用物质的量浓度为0.0225mol·L-1标准I2溶液滴定至终点,消耗标准I2溶液16.02mL。重复以上操作,消耗标准I2溶液15.98mL。计算葡萄酒样品中抗氧化剂的残留量 (单位:mg·L-1,以SO2计算,请给出计算过程。)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com