
| 温度 | 283K | 293K | 303K |
| 溶解度(g/100g H2O) | 2.5 | 3.9 | 5.6 |
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀. | |
| 步骤2:取适量滤液于试管中,滴加稀硫酸. | 出现白色沉淀,说明该试剂中有Ba2+存在 |
| 步骤3:取适量步骤1中的沉淀于试管中,滴加稀盐酸连接带塞导气管将产生的气体导入澄清石灰水中. | 澄清石灰水变混浊.说明该试剂中含有BaCO3 |
| 步骤4:取步骤1中的滤液于烧杯中,用pH计测其pH值 | pH值明显大于9.6,说明该试剂中含有Ba(OH)2. |
分析 (1)Ba(OH)2•8H2O与CO2作用转化为BaCO3;
(2)步骤2:预期现象和结论:有白色沉淀生成,说明有Ba2+;
步骤3:取适量步骤1中的沉淀于是试管中,滴加稀盐酸,用带塞导气管塞紧试管,把导气管插入装有澄清石灰水的烧杯中.
预期现象和结论:试管中有气泡生成,烧杯中的澄清石灰水变浑浊,结合步骤2说明沉淀是BaCO3;
步骤4:取适量滤液于烧杯中,用pH计测其pH值;
预期现象和结论:pH>9.6,说明有大量的OH-,综合上面步骤可知试剂由大量Ba(OH)2•8H2O和少量BaCO3组成,假设成立,
(3)①将样品在烧杯中溶解后,将溶液移入250mL容量瓶中,洗涤将洗涤液移入容量瓶,定容、摇匀;
②盐酸体积最多不能多于50ml,根据50mL计算盐酸的最小浓度,应该是选大于最小浓度而且接近的;
(4)根据氢氧化钡的溶解度估算饱和溶液的物质的量浓度,据此判断.
解答 解:(1)烧杯中未溶物仅为BaCO3,则由于Ba(OH)2•8H2O与CO2作用转化为BaCO3,
故答案为:Ba(OH)2•8H2O与CO2作用转化为BaCO3;
(2)步骤2:预期现象和结论:有白色沉淀生成,说明有Ba2+;
步骤3:取适量步骤1中的沉淀于是试管中,滴加稀盐酸,用带塞导气管塞紧试管,把导气管插入装有澄清石灰水的烧杯中,
预期现象和结论:试管中有气泡生成,烧杯中的澄清石灰水变浑浊,结合步骤2说明沉淀是BaCO3;
步骤4:取适量滤液于烧杯中,用pH计测其pH值.预期现象和结论:pH>9.6,说明有大量的OH-,综合上面步骤可知试剂由大量Ba(OH)2•8H2O和少量BaCO3组成,假设成立,
故答案为:
| 实验步骤 | 预期现象和结论 |
| 出现白色沉淀,说明该试剂中有Ba2+存在 | |
| 滴加稀盐酸 | 澄清石灰水变混浊.说明该试剂中含有BaCO3 |
| 用pH计测其pH值 | pH值明显大于9.6 |
点评 本题考查物质成分与含量测定、对实验方案的理解与设计、溶液配制、中和滴定、化学计算等,题目综合性较大,难度中等,侧重对实验方案设计与化学计算,是对学生综合能力的考查.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | FeS的Ksp小于CuS的Ksp | |
| B. | 达到平衡时c(Fe2+)=c(Cu2+) | |
| C. | 该反应平衡常数K=$\frac{{K}_{sp}(FeS)}{{K}_{sp}(CuS)}$ | |
| D. | 溶液中加入少量Na2S固体后,溶液中c(Cu2+)、c(Fe2+)保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/(L•min) | B. | 0.2mol/(L•min) | C. | 0.3mol/(L•min) | D. | 0.4mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
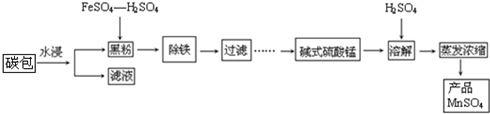
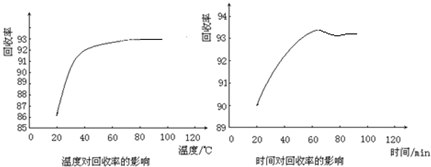
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 苹果酸是一种常见的有机酸,其结构简式如图.苹果酸可能发生的反应是( )
苹果酸是一种常见的有机酸,其结构简式如图.苹果酸可能发生的反应是( )| A. | ①②③ | B. | ①②③④ | C. | ①②③⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稳定性:HF>HCl>HBr>HI | B. | 酸性:H4SiO4<H3PO4<H2SO4<HClO4 | ||
| C. | 粒子半径:Al3+>Mg2+>Na+>F- | D. | 碱性:Al(OH)3<Mg(OH)2<Ca(OH)2<KOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com