
(选做题)(物质结构与性质)已知A、B、C、D、E、F都是短周期的元素,它们的原子序数依次递增。A原子的电子层数与它的核外电子总数相同,而B原子的最外层电子数是次外层的2倍,C的氢化物可使湿润的红色石蕊试纸变蓝,B和D可以形成两种气态化合物,E原子核外电子总数比B的2倍少1,F在本周期元素中原子半径最小。则:
(1)A、B、C、D、E、F的名称分别是 。
(2)在A至F中任选元素,写出一种含极性键的非极性分子的分子式 ,写出一种含非极性键的离子化合物的电子式 。
(3)由B和D组成,且B和D的质量比为3∶8的化合物的结构式是 ,
该化合物分子中B原子的杂化方式为
(4)E和F形成的化合物为 晶体 。
科目:高中化学 来源: 题型:
A、B、C、D分别代表四种不同的短期周期元素。A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素原子的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p轨道中有3个电子。
(1)C原子的电子排布式为______________,若A元素的原子最外层电子排布为1s1,则按原子轨道的重叠方式,A与C形成的化合物中的共价键属于______________键。
(2)当n=2时,B与C形成的晶体属于______________晶体。当n=3时,B与C形成的晶体中微粒间的作用力是______________。
(3)若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2,元素A在周期表中的位置是______________,A、B、C、D四种元素的第一电离能由大到小的顺序是______________(用元素符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。
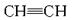
(1)请写出下图中d单质对应元素原子的电子排布式__________________。
(2)单质a、f对应的元素以原子个数比1∶1形成的分子(相同条件下对H2的相对密度为13)中含________个σ键和_________个π键。
(3)a与b的元素形成的10电子中性分子X的空间构型为;将X溶于水后的溶液滴入到AgNO3溶液中至过量,得到配合物的化学式为__________________,其中X与Ag+之间以__________________键结合。
(4)下图是上述六种元素中的一种元素形成的含氧酸的结构;请简要说明该物质易溶于水的原因___________________________。
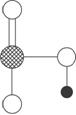
查看答案和解析>>
科目:高中化学 来源: 题型:
铜合金是人类适用最早的金属材料,铜在化合物中常见的化合价有+1、+2价,能形成多种铜的化合物。

(1)基态铜原子的电子排布式为_________________;铜晶体晶胞如上图所示,该晶胞实际拥有_________________个铜原子。
(2)某+1价铜的配离子为[Cu(CN)4]3-,与其配体互为等电子体的一种微粒是_____________。
(3)许多+1价铜的配合物溶液能吸收CO和烯烃(如C2H4、CH3CH=CH2等),CH3CH=CH2分子中C原子采取的杂化方式有_________________。
(4)在硫酸铜溶液中逐滴加入氨水至过量,观察到先出现蓝色沉淀,最后溶解形成深蓝色溶液,写出此蓝色沉淀溶解的离子方程式:_________________;根据价层电子对互斥模型,预测![]() 的空间构型为_________________。
的空间构型为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(选做题)(物质结构与性质)(8分)已知A、B、C、D、E、F都是短周期的元素,它们的原子序数依次递增。A原子的电子层数与它的核外电子总数相同,而B原子的最外层电子数是次外层的2倍,C的氢化物可使湿润的红色石蕊试纸变蓝,B和D可以形成两种气态化合物,E原子核外电子总数比B的2倍少1,F在本周期元素中原子半径最小。则:
(1)A、B、C、D、E、F的名称分别是 。
(2)在A至F中任选元素,写出一种含极性键的非极性分子的分子式 ,写出一种含非极性键的离子化合物的电子式 。
(3)由B和D组成,且B和D的质量比为3∶8的化合物的结构式是 ,
该化合物分子中B原子的杂化方式为
(4)E和F形成的化合物为 晶体 。
查看答案和解析>>
科目:高中化学 来源:2010年河南省郑州四中高三上学期第一次调研考试化学试题 题型:填空题
(选做题)(物质结构与性质)(8分)已知A、B、C、D、E、F都是短周期的元素,它们的原子序数依次递增。A原子的电子层数与它的核外电子总数相同,而B原子的最外层电子数是次外层的2倍,C的氢化物可使湿润的红色石蕊试纸变蓝,B和D可以形成两种气态化合物,E原子核外电子总数比B的2倍少1,F在本周期元素中原子半径最小。则:
(1)A、B、C、D、E、F的名称分别是 。
(2)在A至F中任选元素,写出一种含极性键的非极性分子的分子式 ,写出一种含非极性键的离子化合物的电子式 。
(3)由B和D组成,且B和D的质量比为3∶8的化合物的结构式是 ,
该化合物分子中B原子的杂化方式为
(4)E和F形成的化合物为 晶体。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com