
分析 根据三行式计算HI的平和物质的量,再加入碘单质,HI的转化率降低,但是化学反应的平衡常数不会发生变化,据三行式计算即可.
解答 解:2HI(g)?H2(g)+I2(g)
初始物质的量:1 0 0
变化物质的量:0.244 0.122 0.122
平衡物质的量:0.756 0.122 0.122
所以K=$\frac{0.12{2}^{2}}{0.75{6}^{2}}$=0.026
今欲将HI的分解率降到10%,设:应往此平衡体系中加入I2物质的量是x,
2HI(g)?H2(g)+I2(g)
初始物质的量:1 0 x
变化物质的量:0.1 0.05 0.05+x
平衡物质的量:0.9 0.05 0.05+x
所以K=$\frac{(0.05+x)×0.05}{0.{9}^{2}}$=0.026.解得x≈0.4.
答:应往此平衡体系中加入I2物质的量是0.4mol.
点评 本题考查学生有关化学平衡三行式的计算知识,注意知识的灵活应用是关键,难度中等.


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 25℃时,将一定量的冰醋酸(即无水乙酸)加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法正确的是( )
25℃时,将一定量的冰醋酸(即无水乙酸)加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法正确的是( )| A. | 醋酸的电离平衡常数:a<b<c | |
| B. | 溶液中n(H+):b>a>c | |
| C. | a、b、c三点的溶液都有:c(H+)=c(CH3COO-)+c(OH-) | |
| D. | 从c点到b点,醋酸的电离度不断增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 沉淀a的主要成分是BaS04和BaC03 | |
| B. | 滤液b中Na+的物质的量为0.08 mol | |
| C. | 气体d在标准状况下的体积为224 mL | |
| D. | 原混合物中Na2S04与Na2C03的物质的量之比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上合成甲醇的反应为CO(g)+2H2(g)═CH3OH(g)△H<0.
能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上合成甲醇的反应为CO(g)+2H2(g)═CH3OH(g)△H<0.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
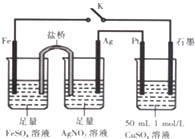
| A. | 盐桥中的电解质可以用KC1 | |
| B. | 导线中流过0.2mol电子时,加入4.9gCu(OH)2,CuSO4溶液可恢复原组成 | |
| C. | 闭合K,石墨电极上只生成铜 | |
| D. | 闭合K,外电路电流方向为Fe电极→石墨电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发操作时,当溶液中出现较多固体应停止加热 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 如果没有试管夹,可以临时手持试管给固体或液体加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH=CH2 烯烃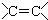 | B. | 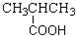 羧酸-COOH 羧酸-COOH | ||
| C. |  醛类 醛类 | D. | RCH2OH (R为烃基) 醇类-OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液.
实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com