
下列各组物质中,不能满足组内任意两种物质间在一定条件下均能发生化学反应的是( )
物质
组别 甲 乙 丙
A Al(OH)3 HCl NaOH
B NH3 O2 H2SO3
C SiO2 NaOH HCl
D SO2 Ca(OH)2 NaHCO3
A. A B. B C. C D. D
考点: 钠的重要化合物;氨的化学性质;硅和二氧化硅.
分析: A.氢氧化铝为两性物质,既能与碱反应又能与酸反应,盐酸与氢氧化钠发生酸碱中和反应;
B.氨气与氧气发生氧化反应,氨气与亚硫酸发生反应生成盐,氧气与亚硫酸反应生成硫酸;
C.二氧化硅与盐酸不反应;
D.SO2与Ca(OH)2反应生成亚硫酸钙和水,SO2与NaHCO3反应生成亚硫酸钠和二氧化碳,且Ca(OH)2与NaHCO3反应生成碳酸钙.
解答: 解:A.氢氧化铝为两性物质,既能与碱反应又能与酸反应,盐酸与氢氧化钠发生酸碱中和反应,符合题意,故A不选;
B.氨气、亚硫酸都具有还原性,都能够被氧气氧化,氨气为碱性气体,能够与亚硫酸反应生成盐,符合体育,故B不选;
C.二氧化硅与氢氧化钠溶液反应,但是与盐酸不反应,故C选;
D.SO2与Ca(OH)2反应生成亚硫酸钙和水,SO2与NaHCO3反应生成亚硫酸钠和二氧化碳,且Ca(OH)2与NaHCO3反应生成碳酸钙,符合题意,故D不选;
故选:C.
点评: 本题考查考查物质之间的反应,把握常见物质的性质及发生的化学反应为解答的关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
某元素的一个原子形成的离子可表示为baXn﹣,下列说法中正确的是(NA表示阿伏伽德罗常数)( )
A. baXn﹣中含有的中子数为a+b B. baXn﹣中含有的电子数为a﹣n
C. X原子的质量约为(b/NA)g D. 此元素的相对原子质量为b
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中正确的是( )
A. NaHCO3能与碱反应,食品工业用作焙制糕点的膨松剂
B. 工业上制H2SO4过程中SO2氧化条件一般选择高温、高压、催化剂
C. 浓H2SO4有强氧化性,常温下能与Cu发生反应
D. 将C12通入冷的消石灰中可制得漂白粉
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学反应的方程式书写正确的是( )
A. 高温下加热硝酸铵固体:NH4NO3 NH3↑+HNO3↑
NH3↑+HNO3↑
B. 将铝片加入烧碱溶液中:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑
C. 向亚硫酸钠溶液中加入足量硝酸:SO32﹣+2H+=SO2↑+H2O
D. 工业制粗硅:C+SiO2 CO2↑+Si
CO2↑+Si
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的情况.下列反应中属于这种情况的是( )
①过量的MnO2与浓盐酸反应
②过量的Zn与18mol•L﹣1的硫酸反应
③过量的Br2与FeI2反应
④过量的H2与N2在催化剂存在下反应.
A. ②④ B. ②③ C. ①③ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
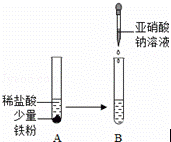
亚硝酸钠(NaNO2)俗称工业盐,外观和食盐相似,有咸味,易溶于水,水溶液显碱性,加强热时能分解产生有刺激性气味的气体,人若误食会引起中毒,致死量为0.3g~0.5g,它使人中毒是因为它能将人体血红蛋白中的Fe2+转化为Fe3+,从而使血红蛋白丧失携氧能力.
(1)以下有关亚硝酸钠的说法正确的是
a.能用紫色石蕊试液测定亚硝酸钠水溶液的酸碱性
b.亚硝酸钠在加强热时分解产生的气体是氨气
c.从使血红蛋白丧失携氧能力的角度看,亚硝酸钠使人中毒的原理与CO相同
d.利用如图进行实验,B试管中的溶液逐渐变成了黄色
(2)已知NaNO2在酸性条件下能使淀粉碘化钾试纸变蓝,同时生成一种无色气体,遇空气变红棕色.因此可选用淀粉碘化钾试纸和 (生活中常见物质)来鉴别工业盐和食盐.涉及到的反应方程式为 , .
(3)某工厂废切削液中含有2%﹣5%的NaNO2,直接排放会造成水污染,但加入下列物质中的某一种就能使NaNO2转化为不引起污染的N2,该物质是
a.NaCl b.HNO3 c.NH4Cl d.浓H2SO4
所发生反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组名词或现象中,三者间没有逐级因果关系的是( )
A.汽车尾气→光化学污染→咳嗽和气喘者增多
B.含磷洗衣粉→水体富营养化→水栖动物大量死亡
C.人口增多→空气中CO2浓度增大→温室效应
D.氟氯烃→臭氧空洞→皮肤癌患者增多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com