
分析 (1)根据2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O知,酸性条件下,平衡向正反应方向移动;
(2)当反应到达平衡状态时正逆反应速率相同、各物质的浓度保持不变;
(3)根据6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O计算.
解答 解:(1)根据2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O知,酸性条件下,平衡向正反应方向移动,所以若平衡体系的pH=2,该溶液是橙色;
故答案为:橙;
(2)A.Cr2O72-与CrO42-的浓度相同时正逆反应速率不一定相等,所以不一定是平衡状态,故A错误;
B.2v(Cr2O72-)=v(CrO42-)时正逆反应速率不一定相等,所以不一定是平衡状态,故B错误;
C.溶液的颜色不变,体系中各物质浓度不变,则该反应达到平衡状态,故C正确;
故答案为:C;
(3)第②步中,还原1mol Cr2O72-,发生的反应为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,则消耗的FeSO4•7H2O为6mol;
故答案为:6.
点评 本题考查了化学平衡移动、平衡状态的判断、氧化还原反应的有关计算,题目难度不大,注意把握发生的反应.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
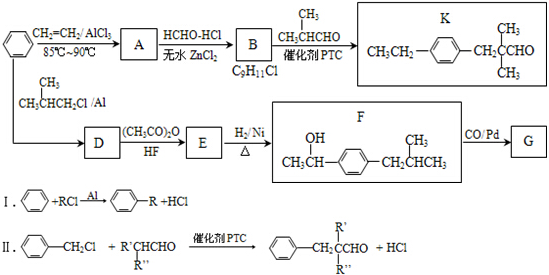
 .
.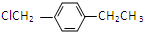 .
.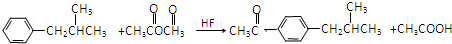 .
.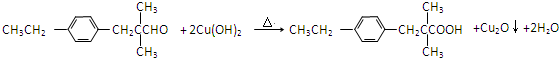
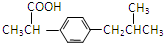 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加A的量,B的转化率提高 | |
| B. | 压强增大平衡不移动,v(正)、v(逆)均不变 | |
| C. | 增大B的浓度,v(正)>v(逆) | |
| D. | 升高温度,平衡向逆反应方向移动,v(正)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
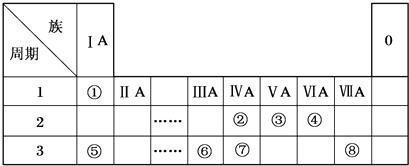
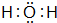 ,B的化学式NH3,C的离子符号NH4+
,B的化学式NH3,C的离子符号NH4+查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇醛糖是一种有机物,不易溶于水 | |
| B. | 乙醇醛糖能发生取代反应、加成反应、氧化反应以及还原反应 | |
| C. | 乙醇醛糖与甲酸乙酯互为同分异构体 | |
| D. | 1 mol 乙醇醛糖与足量的银氨溶液作用,可析出1 molAg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称量时,应将NaOH固体放在小烧杯或玻璃器皿中 | |
| B. | 将烧杯中未冷却的NaOH溶液直接注入未经干燥的容量瓶中 | |
| C. | 定容时视线应平视凹液面(或平视刻度线),直到凹液面的最低点与刻度线相切 | |
| D. | 将称好的NaOH固体放入烧杯中,加入适量水溶解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com