
 甲醇是重要的燃料,有广阔的应用前景:工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)═CH3OH(g)△H1=-116kJ•mol-1
甲醇是重要的燃料,有广阔的应用前景:工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)═CH3OH(g)△H1=-116kJ•mol-1分析 (1)升高温度、增大压强、使用催化剂等均可加快反应速率,结合平衡移动原理分析解答;
(2)已知:①CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1,
②CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H2=-283kJ•mol-1,
③H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H3=-242kJ•mol-1 ,
根据盖斯定律:①-②-③×2得:CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(g);
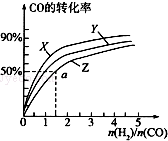
(3)①合成甲醇是放热反应,温度升高,CO的转化率降低;
②a点时,CO转化率50%,反应消耗了2mol×50%=1molCO,图象中可知,起始量氢气物质的量n(H2)=1.5n(CO)=3mol,则:
CO(g)+2H2(g)?CH3OH(g)
起始量(mol) 2 3 0
变化量(mol) 1 2 1
平衡量(mol) 1 1 1
再根据K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$计算平衡常数,相同温度下CH3OH(g)═CO(g)+2H2(g)的平衡常数与 CO(g)+2H2(g)?CH3OH(g)的平衡常数互为倒数;
(4)①恒温下,分别将1molCO和2molH2置于恒容容器I和恒压容器Ⅱ中,正反应为气体体积减小的反应,随反应进行气体物质的量减小,I中压强减小,压强越大反应速率越快,Ⅱ中平衡等效再I中平衡基础上增大压强,平衡正向移动;
②平衡时,测得容器Ⅰ中的压强减小了30%,气体物质的量减小30%,即减少(1+2)mol×30%=0.9mol,利用差量法计算参加反应CO的物质的量,进而计算CO转化率.
解答 解:(1)A.随时将CH3OH与反应混合物分离,减小生成物的浓度,利于反应正向进行,但反应速率减小,故A错误;
B.反应是放热反应,温度降低,利于反应正向进行,但反应速率变小,故B错误;
C.正反应为气体积减小的反应,压强增大,利于反应正向进行,反应速率加快,故C正确;
D.使用催化剂,反应速率加快,不影响化学平衡移动,故D错误;
故选:C;
((2)已知:①CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1,
②CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H2=-283kJ•mol-1,
③H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H3=-242kJ•mol-1 ,
根据盖斯定律:①-②-③×2得:CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(g)△H=-651kJ•mol-1,
故答案为:CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(g)△H=-651kJ•mol-1;
(3)①反应CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1,是放热反应,温度越高,CO转化率越低,所以曲线Z对应的温度最高,X对应的一氧化碳转化率最大,温度最低,Y介于二者之间,在图中三条曲线,对应的温度由高到低的顺序是Z>Y>X;
故答案是:Z>Y>X;
②a点时,CO转化率50%,反应消耗了2mol×50%=1molCO,图象中可知,起始量氢气物质的量n(H2)=1.5n(CO)=3mol,则:
CO(g)+2H2(g)?CH3OH(g)
起始量(mol) 2 3 0
变化量(mol) 1 2 1
平衡量(mol) 1 1 1
容器容积为2L,则平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$=$\frac{0.5}{0.5×0.{5}^{2}}$=4,相同温度下CH3OH(g)═CO(g)+2H2(g)的平衡常数=$\frac{1}{4}$=0.25,
故答案为:0.25;
(4)①恒温下,分别将1molCO和2molH2置于恒容容器I和恒压容器Ⅱ中,正反应为气体体积减小的反应,随反应进行气体物质的量减小,I中压强减小,压强越大反应速率越快,达到平衡需要的时间短,故达到平衡所需时间Ⅰ>Ⅱ;
Ⅱ中平衡等效再I中平衡基础上增大压强,平衡正向移动,所以两容器中CH3OH的体积分数Ⅰ<Ⅱ;
故答案为:>;<;
②平衡时,测得容器Ⅰ中的压强减小了30%,气体物质的量减小30%,即减少(1+2)mol×30%=0.9mol,则:
CO(g)+2H2(g)?CH3OH(g)物质的量减小△n
1 2
0.45mol 0.9mol
则该容器中CO的转化率=$\frac{0.45mol}{1mol}$×100%=45%,
故答案为:45%.
点评 本题考查化学平衡计算与影响因素、化学平衡图象、化学反应速率影响因素、化学平衡常数、热化学方程式的书写等知识,是对学生综合能力的考查,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液加水稀释醋酸的电离程度增大 | |
| B. | 工业合成氨时常用通过过量的氮气的方法提高氢气的转化率 | |
| C. | 新制的氯水在光照的条件下颜色变浅 | |
| D. | 氯化铁溶液中加Fe粉振荡后颜色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1:2: | B. | 1:1:1 | C. | 2:2:1 | D. | 1:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A是CH2=CH2 B是CH3CHO C是CH3CH2OH | |
| B. | A是CH3CHO B是CH2=CH2C是CH3CH2OH | |
| C. | A是CH≡CH B是CH3CH2OH C是CH3CHO | |
| D. | A是CH3CH2OH B是CH3-CH3C是CH≡CH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由水电离的c(H+)=1×10-14mol•L-1的溶液中:Ca2+、K+、Cl-、HCO3- | |
| B. | 甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- | |
| C. | 在pH=0的溶液中:Na+、NO3-、SO32-、K+ | |
| D. | pH=12的溶液:K+、Na+、CH3COO-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吸水性 | B. | 脱水性 | C. | 强氧化性 | D. | 酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L的O2和NO的混合物含有的分子数约为0.5×6.02×1023 | |
| B. | 1mol的羟基与1 mol的氢氧根离子所含电子数均为9 NA | |
| C. | 常温常压下42g 乙烯和丁烯混合气体中,碳氢键的数目为6NA | |
| D. | 6.4g SO2与3.2g氧气反应生成SO3,转移电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液:K+、Cu2+、Br-、SO42- | |
| B. | 含有0.1 mol•L-1I-的溶液:NH4+、Fe3+、SO42-、Cl- | |
| C. | 含有0.1 mol•L-1HCO3-的溶液:Na+、Al3+、NO3-、OH- | |
| D. | 强酸性溶液:K+、Mg2+、NO3-、ClO- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com