
【题目】已知镁能在O2、N2、CO2中燃烧生成相应的化合物。试回答:
(1)镁在空气中燃烧,除发生反应N2+3Mg![]() Mg3N2外,还能发生其他反应,写出反应的化学方程式:____________。
Mg3N2外,还能发生其他反应,写出反应的化学方程式:____________。
(2)镁条在氧气中燃烧时看到的现象是________。
(3)如果等质量的镁分别在足量的氧气、氮气、二氧化碳中燃烧,燃烧后固体的质量分别为m1、m2、m3,则它们的大小顺序为___________。
【答案】2Mg+O2![]() 2MgO、2Mg+CO2
2MgO、2Mg+CO2![]() 2MgO+C 剧烈燃烧,发出耀眼的白光,生成大量白烟 m3>m1>m2
2MgO+C 剧烈燃烧,发出耀眼的白光,生成大量白烟 m3>m1>m2
【解析】
(1)镁在空气中燃烧时,镁可与空气中的氧气、二氧化碳、氮气反应;
(2)镁在氧气中剧烈燃烧,发出耀眼的白光,生成大量白烟;
(3)根据镁在氧气、氮气、二氧化碳中燃烧的方程式计算燃烧后固体的质量。
(1)镁在空气中燃烧能与氧气、氮气、二氧化碳发生反应,反应方程式分别是2Mg+O2![]() 2MgO、N2+3Mg
2MgO、N2+3Mg![]() Mg3N2、2Mg+CO2
Mg3N2、2Mg+CO2![]() 2MgO+C。
2MgO+C。
(2)镁在氧气中剧烈燃烧,发出耀眼的白光,生成大量白烟。
(3)2Mg+O2![]() 2MgO、N2+3Mg
2MgO、N2+3Mg![]() Mg3N2、2Mg+CO2
Mg3N2、2Mg+CO2![]() 2MgO+C。24g镁与O2反应生成1 mol MgO,质量增加16 g;24g镁与N2反应生成
2MgO+C。24g镁与O2反应生成1 mol MgO,质量增加16 g;24g镁与N2反应生成![]() mol Mg3N2,质量增加
mol Mg3N2,质量增加![]() g;24g镁与CO2反应生成1 mol MgO和
g;24g镁与CO2反应生成1 mol MgO和![]() mol C,质量增加22 g,故m3>m1>m2。
mol C,质量增加22 g,故m3>m1>m2。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】请按下列线条提示,画出Fe、Cu、S、H2、HCl、NaOH、H2SO4、Ba(OH)2、NaHCO3、K2O、CuO、NaCl 的树状分类图: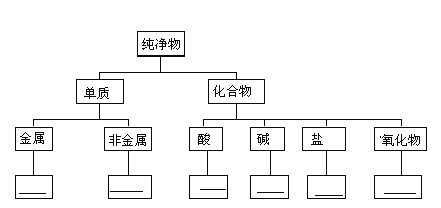
_____ _____ ____ ___ __ ___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列方法中可以证明 2HI(g) ![]() H2(g)+I2(g)已达平衡状态的是_________。
H2(g)+I2(g)已达平衡状态的是_________。
①单位时间内生成 n mol H2 的同时生成 n mol HI;
②一个 H—H 键断裂的同时有一个 H—I键断裂;
③百分组成ω(HI)=ω(I2);
④反应速率v(H2)=v(I2)= ![]() v(HI)时;
v(HI)时;
⑤c(HI):c(H2):c(I2)=2:1:1 时;
⑥温度和体积一定时,某一生成物浓度不再变化;
⑦温度和体积一定时,容器内压强不再变化;
⑧条件一定,混合气体的平均相对分子质量不再变化;
⑨温度和体积一定时,混合气体的颜色不再变化;
⑩温度和压强一定时,混合气体的密度不再变化;
(2)对于合成氨上述能说明达到平衡状态的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】复合氧化钻![]() 可用于生产合金磁性材料、催化剂等。为充分利用资源,在实验室中探究采用含钴废渣(含
可用于生产合金磁性材料、催化剂等。为充分利用资源,在实验室中探究采用含钴废渣(含![]() 等)来制备复合氧化钴,具体流程如下:
等)来制备复合氧化钴,具体流程如下:
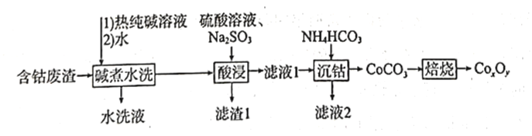
回答下列问题:
(1)![]() 的电子式为_______________________。
的电子式为_______________________。
(2)“碱煮水洗”的目的为______________________________________________。
(3)“酸浸”时,![]() 发生反应的离子方程式为_____________________________________________;滤渣1中主要成分的化学式为_______________________。
发生反应的离子方程式为_____________________________________________;滤渣1中主要成分的化学式为_______________________。
(4)检验“水洗液”中含有![]() 的操作和现象为______________________________________________。上述流程中多次应用过滤操作该操作所用主要玻璃仪器有_____________________。
的操作和现象为______________________________________________。上述流程中多次应用过滤操作该操作所用主要玻璃仪器有_____________________。
(5)下列装置中,适合进行“焙烧”操作的是_____________________(填选项字母)。
A.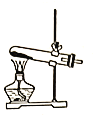 B.
B.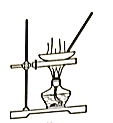 C.
C.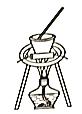 D.
D.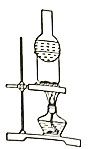
(6)称量![]() ,充分“焙烧”后得复合氧化钴
,充分“焙烧”后得复合氧化钴![]() ,则复合氧化钻的化学式为________________;“焙烧”过程中生成的气体能参与大气循环,则该过程_______________(填“有”或“无”)氧气参加反应。
,则复合氧化钻的化学式为________________;“焙烧”过程中生成的气体能参与大气循环,则该过程_______________(填“有”或“无”)氧气参加反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人提出可以利用海水(含NaCl)和石灰石为原料制取漂白粉,该方法流程如下:
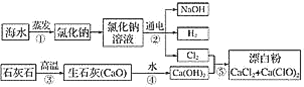
(1)②中的反应物是氯化钠和________,该反应的离子程式为_________。
(2)写出反应④、⑤的化学方程式:_________。
(3)图中反应②③④⑤属于氧化还原反应的是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 的捕捉和综合利用是目前研究的热点之一。回答下列问题:
的捕捉和综合利用是目前研究的热点之一。回答下列问题:
(1)科研工作者发现一种捕获二氧化碳生成甲酸的简单过程如图所示。
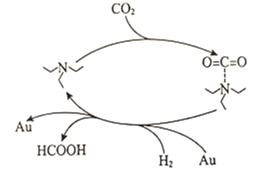
下列说法正确的是__________________(填选项字母)。
A.增大![]() 的物质的量可增大
的物质的量可增大![]() 的平衡产率
的平衡产率
B.![]() 和
和![]() 均能降低反应的活化能
均能降低反应的活化能
C.上述捕获过程能有效减少温室气体排放
(2)![]() 能用于制备二甲醚
能用于制备二甲醚
I.![]()
II.![]()
III.![]()
①二氧化碳气体与氢气生成二甲醚蒸气和水蒸气反应的热化学方程式为______________。
②![]() 时,在恒容密闭容器中发生反应I时,下列事实能说明该反应达到平衡状态的是_____________(填选项字母)。
时,在恒容密闭容器中发生反应I时,下列事实能说明该反应达到平衡状态的是_____________(填选项字母)。
A.气体的平均相对分子质量不再改变
B. ![]() 不再改变
不再改变
C.断裂![]() 键同时断裂
键同时断裂![]() 键
键
D.混合气体的密度不再改变
③![]() 时,向密闭容器中充入一定量
时,向密闭容器中充入一定量![]() ,发生反应Ⅱ,测得反应前压强为
,发生反应Ⅱ,测得反应前压强为![]() ,
,![]() 恰好达到平衡时,
恰好达到平衡时,![]() 的分压为
的分压为![]() ,则
,则![]() 内的反应速率
内的反应速率![]() _____________(用分压表示,下同);反应的平衡常数
_____________(用分压表示,下同);反应的平衡常数![]() _____________。
_____________。
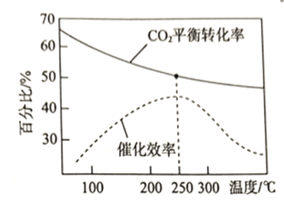
④在催化剂条件下,发生反应![]() 。
。
该反应的![]() ___________0(填“>”或“<”);
___________0(填“>”或“<”);![]() 的平衡转化率和催化剂的催化效率与温度的关系如图所示。则将反应温度选择为
的平衡转化率和催化剂的催化效率与温度的关系如图所示。则将反应温度选择为![]() 的原因为________________________________。
的原因为________________________________。
⑤向某绝热刚性容器中充入一定量的![]() 和
和![]() ,发生反应Ⅲ。容器内平衡压强______________________(填“大于”“小于”或“等于”)起始压强,原因为______________________。
,发生反应Ⅲ。容器内平衡压强______________________(填“大于”“小于”或“等于”)起始压强,原因为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、体积为2L的密闭容器中加入1molCO2和3molH2,发生如下的反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H<0。可认定该可逆反应在一定条件下已达到化学平衡状态的是
CH3OH(g)+H2O(g) △H<0。可认定该可逆反应在一定条件下已达到化学平衡状态的是
A. 容器中CO2、H2、CH3OH、H2O的物质的量之比为1∶3∶1 ∶1
B. v正(CO2)=v逆(H2O)
C. 容器内混合气体密度保持不变
D. 3molH-H键断裂同时生成3molH-O键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2S与CO2在高温下发生反应:H2S(g)+CO2(g)![]() COS(g)+H2O(g) ΔH=-Q kJ·mol1(Q>0)。在温度为T1时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,经过4 min反应达到平衡,平衡时H2O(g)的物质的量分数为2%,则下列说法不正确的是
COS(g)+H2O(g) ΔH=-Q kJ·mol1(Q>0)。在温度为T1时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,经过4 min反应达到平衡,平衡时H2O(g)的物质的量分数为2%,则下列说法不正确的是
A.CO2的平衡转化率α=2.5%
B.0~4 min内用H2S表示该反应的速率为0.001 mol·L1·min1
C.上述条件下反应达到平衡时放出的热量为0.01Q kJ
D.其他条件不变,若该反应在温度为T2条件下进行,达到平衡所需时间小于4 min,则T1<T2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值,某二元酸(简写为
为阿伏加德罗常数的值,某二元酸(简写为![]() )溶液按下式电离:
)溶液按下式电离:![]() ,
,![]() ,关于常温下的下列溶液叙述错误的是( )
,关于常温下的下列溶液叙述错误的是( )
A.![]()
![]() 的
的![]() 溶液的
溶液的![]() 数目为
数目为![]()
B.在![]() 质量分数为46%的
质量分数为46%的![]() 水溶液中,含氧原子总数为
水溶液中,含氧原子总数为![]()
C.![]()
![]() 的
的![]() 溶液中
溶液中![]() 、
、![]() 、
、![]() 、
、![]() 总的粒子数为
总的粒子数为![]()
D.![]() 溶液中一定存在
溶液中一定存在![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com