
 在80℃时,0.40mol的N2O4气体充入2L固定容积的密闭容器中发生如下反应:N2O4(g)?2NO2(g)△H>0,隔一段时间对该容器内的物质进行分析得到如下数据:
在80℃时,0.40mol的N2O4气体充入2L固定容积的密闭容器中发生如下反应:N2O4(g)?2NO2(g)△H>0,隔一段时间对该容器内的物质进行分析得到如下数据:| n(mol) 时间(s) |
0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| ||
| 40s-20s |
| 0.1mol |
| 2L |
| 0.6mol |
| 2L |
| 0.32 |
| 0.05 |
 ,故答案为:
,故答案为: .
.

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:辽宁省沈阳铁路实验中学2012届高三上学期第三次月考化学试题 题型:022
在80℃时,0.40 mol的N2O4气体充入2 L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
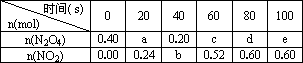
(1)计算20 s-40 s内用N2O4表示的平均反应速率为________.
(2)计算在80℃时该反应的平衡常数K________.
(3)能判断该反应是否已达化学平衡状态的依据是________.
a.容器中压强不变
b.混合气体中c(N2O4)不变
c.v正(NO2)=v逆(N2O4)
d.混合气体密度不变
e.混合气体的平均摩尔质量不变
f.c(N2O4)=c(NO2)
(4)反应进行至100 s后将反应混合物的温度降低,混合气体的颜色________(填“变浅”、“变深”或“不变”).
(5)要增大该反应的K值,可采取的措施有(填序号)________,若要重新达到平衡时,使[NO2]/[N2O4]值变小,可采取的措施有(填序号)________.
A.增大N2O4的起始浓度
B.向混合气体中通入NO2
C.使用高效催化剂
D.升高温度
(6)如下图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线.
查看答案和解析>>
科目:高中化学 来源: 题型:
在80℃时,0.40mol的N2O4气体充入 2L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(1)计算20s—40s内用N2O4表示的平均反应速率为 。
(2)计算在 80℃时该反应的平衡常数K 。
(3)能判断该反应是否已达化学平衡状态的依据是________________。
a.容器中压强不变
b.混合气体中c(N2O4)不变
c.v正(NO2)=v逆(N2O4)
d.混合气体密度不变
e.混合气体的平均摩尔质量不变
f.c(N2O4)= c(NO2)
(4)反应进行至100s后将反应混合物的温度降低,混合气体的颜色 (填“变浅”、“变深”或“不变”)。
(5)要增大该反应的K值,可采取的措施有(填序号) ,若要重新达到平衡时,使[NO2]/[N2O4]值变小,可采取的措施有(填序号) 。
A.增大N2O4的起始浓度 B.向混合气体中通入NO2
C.使用高效催化剂 D.升高温度
(6)如右图是 80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在 60℃时N2O4物质的量的变化曲线。
查看答案和解析>>
科目:高中化学 来源: 题型:
(14分)在80℃时,0.40mol的N2O4气体充入2L固定容积的密闭容器中发生如下反应:N2O4(g) 2 NO2(g) ΔH>0 ,隔一段时间对该容器内的物质进行分析得到如下数据:
|
| 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(1)求b、e的值:b= ,e=
(2)计算20s—40s内用N2O4表示的平均反应速率为 ;80℃该反应的化学平衡常数K为
(3)改变条件并达到新平衡,要使NO2在平衡体系中的含量变小,可采取的措施有(填序号) 。
A.向混合气体中再通入N2O4 B.保持容积不变,通入He
C.使用高效催化剂 D.降低温度
(4)如果在80℃、将0.40mol的N2O4气体放入一个起始体积为2L、且压强维持不变的容器中发生上述反应。则达到平衡时n(NO2) 0.60mol(填“ 大于 ” “等于” 或“ 小于”)
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年广东汕头市毕业班教学质量监测理综化学部分 题型:填空题
在80℃时,0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
|
时间(s) n(mol) |
0 |
20 |
40 |
60 |
80 |
100 |
|
n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
|
n(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
(1)计算20s~40s内用N2O4表示的平均反应速率为 。
(2)计算在80℃时该反应的平衡常数K 。
(3)反应进行至100s后将反应混合物的温度降低,混合气体的颜色 (填“变浅”、“变深”或“不变”)。
(4)要增大该反应的K值,可采取的措施有(填序号) ,若要重新达到平衡时,使[NO2]/[N2O4]值变小,可采取的措施有(填序号) 。
A.增大N2O4的起始浓度 B.向混合气体中通入NO2
C.使用高效催化剂 D.升高温度
(5)如右图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com