


 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源: 题型:
| A、Cu(OH)2>CuCO3>CuS |
| B、CuS>Cu(OH)2>CuCO3 |
| C、CuS<Cu(OH)2<CuCO3 |
| D、Cu(OH)2<CuCO3<CuS |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、RCl>RI>R2CrO4 |
| B、RCl>R2CrO4>RI |
| C、R2CrO4>RCl>RI |
| D、R2CrO4>RI>RCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2分子的结构式:O-C-O | ||
B、Na+的结构示意图: | ||
C、NH3分子的电子式: | ||
D、质量数为18的氧原子:
|
查看答案和解析>>
科目:高中化学 来源: 题型:
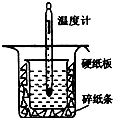 中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题:
中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题:| 温度 实验次数 |
起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滴加甲基橙溶液呈黄色 | ||||
| B、c(HCO3-)>c(H2CO3)>c(CO32-) | ||||
| C、c(OH-)=c(H+)+c(H2CO3)-c(CO32-) | ||||
D、加水稀释,
|
查看答案和解析>>
科目:高中化学 来源: 题型:
- 3 |
2- 4 |
- 3 |
2- 4 |
c(N
| ||
| c(Pb2+) |
c(N
| ||
| c(Pb2+) |
| 离 子 | Pb2+ | Ca2+ | Fe3+ | Mn2+ | Cl- |
| 处理前浓度/(mg?L-1) | 0.100 | 29.8 | 0.120 | 0.087 | 51.9 |
| 处理后浓度/(mg?L-1) | 0.004 | 22.6 | 0.040 | 0.053 | 49.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com