
将磁性氧化铁放入稀HNO3中可发生如下反应:3Fe3O4+28HNO3=9Fe(NO3)x+NO↑+14H2O,下列判断合理的是
| A.Fe(NO3)x中的x为2 |
| B.磁性氧化铁中的铁元素全部被氧化 |
| C.稀HNO3在反应中只作氧化剂 |
| D.反应中每生成0.4 mol还原产物,就有1.2 mol电子转移 |
 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:单选题
下列说法中,不正确的是
| A.利用铁加入硫酸铜溶液中的反应不可以比较Cu、Fe2+的还原性: |
| B.足量的铜跟一定量的浓硝酸反应只产生一种气体 |
| C.氮的固定不一定只有在高温、高压、催化剂的条件下才能实现 |
| D.用苯萃取溴水中的Br2时,有机层从分液漏斗的下端放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
需要加入适当的氧化剂才能实现的反应是
| A.MnO2 → Mn2+ | B.SO2 → SO32- |
| C.Cl2 → HCl | D.PCl3 → PCl5 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
高锰酸钾溶液在酸性条件下可以与硫酸亚铁反应,化学方程式如下(未配平):
KMnO4+ FeSO4+ H2SO4= K2SO4+ MnSO4+ Fe2(SO4)3+ H2O
下列说法正确的是
| A.MnO4-是氧化剂,Fe3+是还原产物 |
| B.Fe2+的还原性强于Mn2+ |
| C.取反应后的溶液加KSCN溶液,可观察到有血红色沉淀生成 |
| D.生成1mol水时,转移2.5mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
单质硫在KOH的热溶液中发生岐化反应:3 S + 6 KOH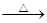 2 K2S + K2SO3 + 3 H2O
2 K2S + K2SO3 + 3 H2O
若硫过量,进一步生成K2Sx(x ≤ 5)和K2S2O3。将0.08 mol单质硫与含0.06 mol KOH的热溶液充分反应恰好生成a mol K2Sx和b mol K2S2O3,再加入足量KClO-KOH的混合溶液,硫元素全部转化为K2SO4,转移电子n mol。则以下正确的是
| A.a = 2b | B.x = 2 | C.n = 0.48 | D.b = 0.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
水热法制备纳米颗粒Y(化合物)的反应为3Fe2++2S2O32-+O2+aOH-=Y+S4O62-+2H2O,下列说法中,不正确的是( )
| A.a=4 |
| B.Y的化学式为Fe2O3 |
| C.S2O32-是还原剂 |
| D.每有1 mol O2参加反应,转移的电子为4 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
铬是人体必需的微量元素,但铬过量会引起污染,危害人体健康。不同价态的铬毒性不一样,六价铬的毒性最大。下列叙述错误的是( )
| A.K2Cr2O7可以氧化乙醇,可用来鉴别司机是否酒后驾驶 |
| B.污水中铬一般以Cr3+存在,与水中的溶解氧作用可被还原为六价铬 |
| C.人体内六价铬超标,服用维生素C缓解毒性,说明维生素C具有还原性 |
D.1 mol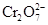 得到6 mol电子时,还原产物是Cr3+ 得到6 mol电子时,还原产物是Cr3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某元素在化学反应中,由化合态变成游离态,则下列说法中正确的是( )
①该元素一定被氧化 ②该元素一定被还原 ③该元素可能被氧化,也可能被还原 ④元素化合价降为0 ⑤生成的单质为氧化产物 ⑥生成的单质为还原产物 ⑦生成的单质既可能为氧化产物也可能为还原产物 ⑧该过程不一定非得加氧化剂或还原剂才能实现 ⑨该反应不一定是放热反应 ⑩该反应一定不是复分解反应
| A.③⑦⑧⑨⑩ | B.①⑤⑩ | C.②④⑥⑩ | D.①②④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
从矿物学资料查得,一定条件下自然界存在如下反应:14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,下列说法正确的是( )
| A.Cu2S既是氧化产物又是还原产物 |
| B.5 mol FeS2发生反应时有10 mol电子转移 |
C.产物中的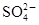 有一部分是氧化产物 有一部分是氧化产物 |
| D.FeS2只作还原剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com