
| A. | 3种 | B. | 4种 | C. | 6种 | D. | 8种 |
科目:高中化学 来源: 题型:选择题
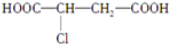 $→_{△}^{NaOH_{2}醇}$D$\stackrel{H+}{→}$E$→_{浓H_{2}SO_{4}}^{CH_{3}OH}$CH3OOC-CH=CH-COOCH3,则B物质应为下列哪种物质( )
$→_{△}^{NaOH_{2}醇}$D$\stackrel{H+}{→}$E$→_{浓H_{2}SO_{4}}^{CH_{3}OH}$CH3OOC-CH=CH-COOCH3,则B物质应为下列哪种物质( )| A. | 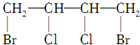 | B. | 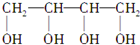 | C. | 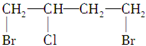 | D. | 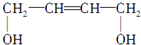 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷在点燃前需进行验纯 | |
| B. | 甲烷能使酸性高锰酸钾溶液褪色 | |
| C. | 甲烷的一氯代物只有一种结构证明甲烷是正四面体结构而非平面正方形结构 | |
| D. | 甲烷不能发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加CO的量 | B. | 增大压强 | C. | 升高温度 | D. | 加入稀有气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiH4的空间构型是正四面体 | |
| B. | 在NH4+和[Cu(NH3)4]2+中都存在配位键 | |
| C. | 原子晶体中原子以共价键结合,具有键能大、硬度大的特性 | |
| D. | SO2、SO3都是极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 高铁酸钾(K2FeO4)具有极强的氧化性,可作为水处理剂和高容量电池材料.
高铁酸钾(K2FeO4)具有极强的氧化性,可作为水处理剂和高容量电池材料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 叙述 | 评价 |
| A | 乙酸乙酯在H218O中水解,产物乙醇中将含有18O | 错,根据酯的水解规律,产物乙酸中将含有18O同位素,而乙醇则没有 |
| B | 淀粉与20%的硫酸混合液在沸水浴中充分加热后滴加碘水无蓝色现象,则说明淀粉水解完全 | 错,淀粉水解后未加碱中和至溶液呈碱性 |
| C | 溴乙烷与NaOH溶液共热充分反应后,再加入AgNO3溶液,能观察到浅黄色沉淀 | 对,溴乙烷水解产生了溴离子 |
| D | 可以用新制的Cu(OH)2悬浊液鉴别乙醇溶液、乙酸溶液和葡萄糖溶液 | 错,用新制的Cu(OH)2悬浊液鉴别乙醇溶液和乙酸溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li2SO4难溶于水 | B. | Li遇浓硫酸产生“钝化”现象 | ||
| C. | LiOH的水溶液不能使酚酞变红 | D. | Li2CO3受热分解,生成Li2O和CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com