
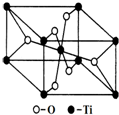
 钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属.目前生产钛采用氯化法,即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4:
钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属.目前生产钛采用氯化法,即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4:分析 (1)根据构造原理,由原子序数即可写出基态原子的电子排布式,进而可写出价电子排布式;
(2)根据等电子体的概念写出符合题目要求的等电子体;
(3)可根据分子的构型来判断碳的杂化方式,四面体形属于sp3杂化,平面形中的碳属于sp2杂化,直线形中的碳属于sp杂化;
(4)根据题目中提供的物理性质来判断晶体类型;
(5)络合物由內界和外界组成,络合物溶于水发生电离生成內界离子(络离子)和外界离子,与BaCl2或AgNO3溶液反应的离子肯定为外界离子,由此可判断络合物的组成;
(6)观察晶胞,数数Ti周围距离最近的O的个数即为Ti的配位数.
解答 解:(1)钛为22号元素,基态电子排布式为:[Ar]3d24s2,则基态钛原子的价电子排布式为3d24s2,故答案为:3d24s2;
(2)CO为双原子分子,价电子总数为10,则CO的等电子体为离子的为:CN-(或NO+.C22-),故答案为:CN-(或NO+.C22-);
(3)在CH2Cl2.HCHO.CO2.C2H4中,分子构型分别为四面体形、平面三角形、直线形、平面形,所以碳原子的杂化方式分别为sp3、sp2、sp、sp2杂化,采取sp2杂化的分子有HCHO、C2H4,故答案为:HCHO、C2H4;
(4)因TiCl4在常温下是无色液体,说明熔点低,在水或潮湿空气中易水解而冒白烟,说明钛离子为弱碱阳离子,由此可判断 TiCl4是由共价键结合的分子,晶体类型属于分子晶体.故答案为:分子;
(5)由[Co(NH3)5Br]SO4可知,硫酸根离子为配合物的外界,在水溶液中以离子形式存在,所以会与钡离子结合成白色沉淀.加入BaCl2溶液时,无明显现象,说明硫酸根离子在内界,若加入AgNO3溶液时,产生淡黄色沉淀,说明溴离子在外界,因此另一配合物的化学式为[Co (NH3)5SO4]Br.
故答案为:产生白色沉淀;[Co (NH3)5SO4]Br;
(6)观察晶胞结构,可知每个钛周围距离最近的氧原子有6个,即钛的配位数为6,故答案为:6.
点评 本题考查了电子排布式的书写、等电子体原理、杂化类型的判断、配合物的组成及性质、晶体类型的判断及晶体结构等知识.这些都是高考的热点,是物质结构和性质的核心,应熟练掌握.本题易错点是没注意题目要求,如价电子排布式写成了基态原子的电子排布式,等电子体要求写离子,容易把分子也写上.


科目:高中化学 来源: 题型:多选题
| A. | 若A2和B2的总能量大于生成的AB的总能量,则反应放热 | |
| B. | 若A2和B2的总能量小于生成的AB的总能量,则反应放热 | |
| C. | 若该反应为放热反应,则Q1+Q2>Q3 | |
| D. | 若该反应为吸热反应,则Q1+Q2>Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:Na+>Mg2+>Al3+>F- | |
| B. | 热稳定性:HCl>H2S>PH3>AsH3 | |
| C. | 酸性强弱:Al(OH)3<H2SiO3<H2CO3<H2SO4 | |
| D. | 碱性强弱:KOH>NaOH>Mg(OH)2>Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生石灰与水作用制熟石灰 | |
| B. | 灼热的木炭与CO2反应 | |
| C. | 甲烷在氧气中的燃烧反应 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水中一水合氨的电离方程式:NH3•H2O═NH4++OH- | |
| B. | 氢氧化钡溶液跟稀硫酸反应的离子方程式:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| C. | 苯和硝酸反应的化学方程式: | |
| D. | 25℃、101 kPa时,1 g甲醇完全燃烧生成CO2和液态水放出22.68 kJ的热量,其热化学方程式为:2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(1)△H=-45.36 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
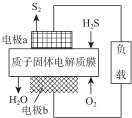 H2S废气资源化利用途径之一是回收能量并得到单质硫.反应原理为:2H2S(g)+O2(g )═S2(s)+2H2O(l)△H=-632kJ•mol-1.图为质子膜H2S燃料电池的示意图.下列说法正确的是( )
H2S废气资源化利用途径之一是回收能量并得到单质硫.反应原理为:2H2S(g)+O2(g )═S2(s)+2H2O(l)△H=-632kJ•mol-1.图为质子膜H2S燃料电池的示意图.下列说法正确的是( )| A. | 电极a为电池的正极 | |
| B. | 电极 b 上发生的电极反应为:O2+4H++4e-═2H2O | |
| C. | 该装置是一种将热能转化为电能的装置 | |
| D. | H+经质子膜进入a极区 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 臭氧 | B. | 二氧化氮 | C. | 二氧化硫 | D. | 二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
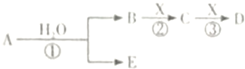 A、B、C、D、E是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分产物和反应条件略去):
A、B、C、D、E是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分产物和反应条件略去):查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com