
| A、第二周期元素从左到右,最高正价从+1递增到+7 |
| B、最外层有5个电子的原子对应的元素肯定是非金属元素 |
| C、同周期金属元素的化合价越高,其原子失电子能力越强 |
| D、ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AgCl沉淀溶解平衡正向移动 |
| B、AgCl溶解度增大 |
| C、溶液中c(Ag+)增大 |
| D、溶液中c(Cl-)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所有的放热反应在常温常压下都容易进行 |
| B、Ba(OH)2?8H2O与NH4Cl反应属吸热反应 |
| C、天然气燃烧时,其化学能全部转化为热能 |
| D、反应热只与反应体系的始态和终态有关,而与反应的途径无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2S分子中,S为sp杂化,为直线形 |
| B、BCl3中B原子sp2杂化,为平面三角形 |
| C、CS2中C原子sp杂化,为直线形 |
| D、PCl3中P原子sp3杂化,为三角锥形 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器.其它条件相同时,在Ⅰ、Ⅱ中分别加入2mol X和2mol Y,起始时容器体积均为V L,发生如下反应并达到平衡(X、Y状态未知):2X(?)+Y(?)?aZ(g).此时Ⅰ中X、Y、Z的物质的量之比为1:3:2,则下列说法一定正确的是( )
如图,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器.其它条件相同时,在Ⅰ、Ⅱ中分别加入2mol X和2mol Y,起始时容器体积均为V L,发生如下反应并达到平衡(X、Y状态未知):2X(?)+Y(?)?aZ(g).此时Ⅰ中X、Y、Z的物质的量之比为1:3:2,则下列说法一定正确的是( )| A、若X、Y均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ |
| B、若X、Y不均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ |
| C、a为2 |
| D、平衡时Ⅰ容器的体积小于V L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 2 |
| 3 |
| 2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe(OH)3;Fe2O3 |
| B、Fe (OH)2;FeO |
| C、Fe (OH)2、Fe(OH)3;Fe3O4 |
| D、Fe2O3;Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
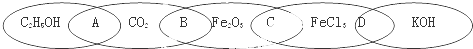
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com