
| A£® | Čō¢ń“ļĘ½ŗāŹ±£¬A”¢B”¢Cø÷Ōö¼Ó1mol£¬ŌņAµÄ×Ŗ»ÆĀŹ½«Ņ»¶ØŌö“ó | |
| B£® | ČōĻņ¢ńĘ½ŗāĢåĻµÖŠŌŁ¼ÓČė1molAŗĶ3molB£¬CµÄĢå»ż·ÖŹżČō“óÓŚx£¬æɶĻ¶Øn£¾3 | |
| C£® | Čō¢ņĢåĻµĘšŹ¼ĪļÖŹµÄĮæµ±Āś×ć9a+c=3b£¬ŌņæÉÅŠ¶Ļn=3 | |
| D£® | Čōn=2£¬Ōņ¢ņĢåĻµĘšŹ¼ĪļÖŹµÄĮæÓ¦Āś×ć1£¼b£¼3 |
·ÖĪö ŌŚŗćĪĀŗćČŻµÄĆܱÕČŻĘ÷ÖŠ£¬½«1molAŗĶ3molBŌŚŅ»¶ØĢõ¼žĻĀ·“Ó¦£¬“ļĘ½ŗāŹ±CµÄĢå»ż·ÖŹżĪŖx£¬ČōĘšŹ¼Ź±A”¢B”¢CĶ¶ČėµÄĪļÖŹµÄĮæ·Ö±šĪŖa”¢b”¢c£¬Ę½ŗāŹ±CµÄĢå»ż·ÖŹżŅ²ĪŖx£¬¶žÕßÓ¦ĪŖµČŠ§Ę½ŗā£¬Ó¦“ęŌŚa+$\frac{1}{n}$c=1£¬b+$\frac{2}{n}$c=3£¬ŅŌ“Ė½ā“šøĆĢā£®
½ā“š ½ā£ŗŌŚŗćĪĀŗćČŻµÄĆܱÕČŻĘ÷ÖŠ£¬½«1molAŗĶ3molBŌŚŅ»¶ØĢõ¼žĻĀ·“Ó¦£¬“ļĘ½ŗāŹ±CµÄĢå»ż·ÖŹżĪŖx£¬ČōĘšŹ¼Ź±A”¢B”¢CĶ¶ČėµÄĪļÖŹµÄĮæ·Ö±šĪŖa”¢b”¢c£¬Ę½ŗāŹ±CµÄĢå»ż·ÖŹżŅ²ĪŖx£¬¶žÕßÓ¦ĪŖµČŠ§Ę½ŗā£¬Ó¦“ęŌŚa+$\frac{1}{n}$c=1£¬b+$\frac{2}{n}$c=3£¬
A£®ÓÉÓŚnÖµ²»Č·¶Ø£¬ŌņČō¢ń“ļĘ½ŗāŹ±£¬A”¢B”¢Cø÷Ōö¼Ó1mol£¬BµÄ×Ŗ»ÆĀŹ²»ÄÜČ·¶Ø£¬¹ŹA“ķĪó£»
B£®ŅņČŻĘ÷Ģå»ż²»±ä£¬Čōx=3Ź±£¬CµÄĢå»ż·ÖŹżÓ¦ĪŖx£¬ĻÖ“óÓŚx£¬xÓ¦Š”ÓŚ3£¬“Ł½ųĘ½ŗāÕżĻņŅĘ¶Æ£¬¹ŹB“ķĪó£»
C£®ÓÉŗćĪĀŗćČŻŹ±£¬µ±a”¢b”¢cĪŖĘšŹ¼ĪļÖŹµÄĮæ£¬Ę½ŗāŹ±CµÄĢå»ż·ÖŹżČŌĪŖx£¬a+$\frac{1}{n}$c=1£¬b+$\frac{2}{n}$c=3£¬Čōn=3£¬¶žÕßĮŖŹ½æɵĆ9a+c=3b£¬¹ŹCÕżČ·£»
D£®ÓÉŗćĪĀŗćČŻŹ±£¬µ±a”¢b”¢cĪŖĘšŹ¼ĪļÖŹµÄĮæ£¬Ę½ŗāŹ±CµÄĢå»ż·ÖŹżČŌĪŖx£¬a+$\frac{1}{n}$c=1£¬b+$\frac{2}{n}$c=3£¬Čōn=2£¬¶žÕßĮŖŹ½æɵĆb=2a+1£¬ÓÉÓŚ0£¼a£¼1£¬Ōņ1£¼b£¼3£¬¹ŹDÕżČ·£»
¹ŹŃ”CD£®
µćĘĄ ±¾Ģāæ¼²é»ÆŃ§Ę½ŗāµÄ¼ĘĖć£¬ĢāÄæÄŃ¶Č½Ļ“ó£¬×¢Ņā“ӵȊ§Ę½ŗāµÄ½Ē¶Č½ā“šøĆĢā£¬ŅדķµćĪŖA£¬×¢Ņān²»Č·¶Ø£¬A”¢B”¢Cø÷Ōö¼Ó1mol£¬BµÄ×Ŗ»ÆĀŹæÉÄÜŌö¼Ó£¬Ņ²æÉÄܲ»±ä£®


 ½Ģ²ÄČ«½ā×Ö“Ź¾äĘŖĻµĮŠ“š°ø
½Ģ²ÄČ«½ā×Ö“Ź¾äĘŖĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
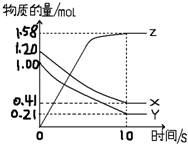 Ņ»¶ØĪĀ¶ČĻĀ£¬ŌŚ2LµÄĆܱÕČŻĘ÷ÖŠ£¬X”¢Y”¢ZČżÖÖĘųĢåµÄĪļÖŹµÄĮæĖꏱ¼ä±ä»ÆµÄĒśĻßČēĶ¼ĖłŹ¾£ŗ
Ņ»¶ØĪĀ¶ČĻĀ£¬ŌŚ2LµÄĆܱÕČŻĘ÷ÖŠ£¬X”¢Y”¢ZČżÖÖĘųĢåµÄĪļÖŹµÄĮæĖꏱ¼ä±ä»ÆµÄĒśĻßČēĶ¼ĖłŹ¾£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĒāŃõ»ÆÄĘÓėŃĪĖį£»ĒāŃõ»ÆĶÓėŃĪĖį | B£® | BaCl2ÓėNa2SO4£»Ba£ØOH£©2ÓėH2SO4 | ||
| C£® | Na2CO3ÓėĻõĖį£»CaCO3ÓėĻõĖį | D£® | ŹÆ»ŅŹÆÓėĻõĖį·“Ó¦£»ŹÆ»ŅŹÆÓėŃĪĖį |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | NaAµÄČÜŅŗ³Ź¼īŠŌ | B£® | pH=2µÄHAČÜŅŗĻ”ŹĶ100±¶ŗópH=3.5 | ||
| C£® | 0.01 mol•L”„1HAČÜŅŗµÄpH=4 | D£® | HAČÜŅŗøśŠæ·“Ó¦£¬·Å³öH2ŗÜĀż |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
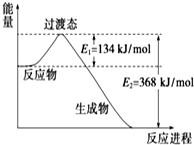 £Ø1£©ČēĶ¼ŹĒNO2ŗĶCO·“Ӧɜ³ÉCO2ŗĶNO¹ż³ĢÖŠÄÜĮæ±ä»ÆŹ¾ŅāĶ¼£¬ĒėŠ“³öNO2ŗĶCO·“Ó¦µÄČČ»Æѧ·½³ĢŹ½£ŗNO2£Øg£©+CO£Øg£©=CO2£Øg£©+NO£Øg£©”÷H=-234KJ/mol£®
£Ø1£©ČēĶ¼ŹĒNO2ŗĶCO·“Ӧɜ³ÉCO2ŗĶNO¹ż³ĢÖŠÄÜĮæ±ä»ÆŹ¾ŅāĶ¼£¬ĒėŠ“³öNO2ŗĶCO·“Ó¦µÄČČ»Æѧ·½³ĢŹ½£ŗNO2£Øg£©+CO£Øg£©=CO2£Øg£©+NO£Øg£©”÷H=-234KJ/mol£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 2A+3B=2C | B£® | A+3B2=C | C£® | 3A+B=2C | D£® | A+B=C |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | K+”¢Na+”¢SO42-”¢NO3- | B£® | Na+”¢K+”¢ClO-”¢CO32- | ||
| C£® | Fe2+”¢Mg2+”¢Cl-”¢SO42- | D£® | NH4+”¢Cl-”¢K+”¢SO32- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | X2±»»¹Ō£¬X2ŹĒ»¹Ō¼Į | B£® | Y2±»Ńõ»Æ£¬Y2ŹĒŃõ»Æ¼Į | ||
| C£® | X2±»Ńõ»Æ£¬X2ŹĒ»¹Ō¼Į | D£® | Y2±»Ńõ»Æ£¬Y2ŹĒ»¹Ō¼Į |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com