
| A.H3BO3的酸性与H2CO3的酸性 |
| B.向Ag2CrO4浑浊液中加NaCl溶液,有AgCl沉淀生成,Ksp (Ag2CrO4) 与Ksp(AgCl) |
| C.I2在KI溶液中和在水中的溶解度 |
| D.相同温度下,lO ml O.l mol·l一的醋酸与100 ml O.01 mol·L一的醋酸中的H+物质的量 |
科目:高中化学 来源:不详 题型:填空题



| A.降低温度 | B.增加了生成物 | C.减小压强 | D.使用了高效催化剂 |


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H2(g) + CO2(g)的平衡常数随温度的变化如下表:
H2(g) + CO2(g)的平衡常数随温度的变化如下表:| 温度/℃ | 400 | 500 | 850 |
| 平衡常数 | 9.94 | 9 | 1 |
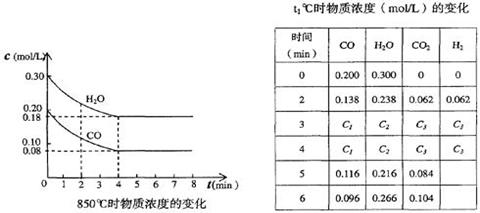
| 时 间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 | |
 1/2N2O4(g) △H = -26.35 kJ·mol-1
1/2N2O4(g) △H = -26.35 kJ·mol-1查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


| A.向容器中按原比例再充入原料气 | B.向容器中再充入惰性气体 |
| C.改变反应的催化剂 | D.液化生成物分离出氨 |

| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3 在恒容密闭容器中进行,达到平衡状态的标志是
2NH3 在恒容密闭容器中进行,达到平衡状态的标志是 | 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| C(NH3)/mol·L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
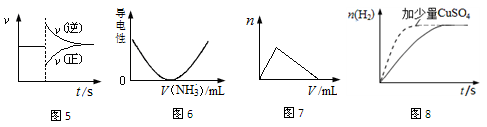
| A.图5可以表示对某化学平衡体系改变温度后反应速率的变化 |
| B.图6可以表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 |
| C.图7可以表示向明矾溶液中滴加氢氧化钠溶液产生沉淀量的变化 |
| D.图8可以表示足量锌粉与稀硫酸反应,加少量CuSO4固体产生H2的变化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表:
H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表:| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
| 实验编号 | 反应物投入量 | 平衡时H2浓度 | 吸收或放出的热量 | 反应物转化率 |
| A | 1、1、0、0 | c1 | Q1 | α1[来源:] |
| B | 0、0、2、2 | c2 | Q2 | α2 |
| C | 2、2、0、0 | c3 | Q3 | α3 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 +SO2
+SO2 +H2O下列各组实验中溶液最先变浑浊的是
+H2O下列各组实验中溶液最先变浑浊的是 | 组号 | | 参加反应的物质 | ||||
| 反应温度(℃) | 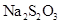 |  |  | |||
| V(mL) | C(mol/L) | V(mL) | C(mol/L) | V(mL) | ||
| A | 10 | 5 | 0.1 | 5 | 0.1 | 5 |
| B | 10 | 5 | 0.1 | 5 | 0.1 | 10 |
| C | 30 | 5 | 0.2 | 5 | 0.2 | 5 |
| D | 30 | 5 | 0.2 | 5 | 0.2 | 10 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 NO(g)+6H2O(g) △H=-bkJ/mol
NO(g)+6H2O(g) △H=-bkJ/mol 则N2(g)+3H2(g) 2NH3(g)的△H= ;
则N2(g)+3H2(g) 2NH3(g)的△H= ;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com