
| A. | 4 | B. | 5 | C. | 6 | D. | 7 |
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案科目:高中化学 来源: 题型:解答题
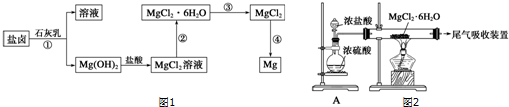
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由X、Z、M三种元素组成的化合物一定是共价化合物 | |
| B. | Q与M形成的化合物可以作为光导纤维的主要原料,且不与任何酸反应 | |
| C. | 元素的非金属性由强到弱的顺序:M>Z>Q>Y | |
| D. | 原子半径由大到小的顺序:N>Q>Z>M |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NO3-、BF3、N2O | B. | SO3、CO2、NO2 | C. | CO、N2、CN- | D. | CO2、SCN-、NO2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液与氢氧化铜反应:2CH3COOH+Cu(OH)2 Cu2++2CH3COO-+2H2O | |
| B. | 乙酸与碳酸钠溶液反应:2H++CO32-═CO2↑+H2O | |
| C. | 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O$\stackrel{△}{→}$2C6H5OH+CO32- | |
| D. | 甲酸溶液与足量的银氨溶液共热HCOOH+4[Ag(NH3)2]++4OH-$\stackrel{△}{→}$CO32-+2NH4++4Ag↓+6NH3+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;该化合物中Y的杂化轨道类型是sp3.
;该化合物中Y的杂化轨道类型是sp3.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com