

| 温度(℃) | 20 | 40 | 60 | 100 |
| 溶解度(g) | 5.0 | 8.7 | 14.8 | 40.2 |
| 金属阳离子 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| pH | 3.2 | 5.2 | 9.7 | 12.4 |
| 化学式 | H2CO3 | HF |
| 电离常数 | K1=4.4×10-7 K2=4.7×10-11 | K=6.75×10-4 |
分析 由流程可知,加硫酸溶解只有SiO2不溶,CaO转化为微溶于水的CaSO4,趁热过滤,防止H3BO3从溶液中析出,“除杂”需先加H2O2溶液,将亚铁离子转化为铁离子,再加入MgO调节溶液的pH约为5.2,使铁离子、铝离子均转化为沉淀,则滤渣为氢氧化铝、氢氧化铁,然后蒸发浓缩、冷却结晶、过滤分离出H3BO3.
(1)应分批加入H2SO4,降低反应速率;
(2)增大反应物浓度、升高温度等方法都可以提高反应速率;H3BO3的溶解度随着温度升高而增大;
(3)加适量H2O2把Fe2+氧化为Fe3+,加MgO调节PH,使Fe3+、Al3+转化为沉淀而除去,所以除去的离子有Fe3+、Fe2+、Al3+;
(4)根据图2可知,温度越高MgSO4•H2O的溶解度越小,由于溶液的沸点随压强增大而升高,为了防止溶液沸腾,应该在较高的压强条件下加热,使MgSO4•H2O结晶析出;
(5)根据硼酸的电离平衡常数可知,c(H+)=$\sqrt{K.c({H}_{3}B{O}_{3})}$;
(6)相同温度、浓度下,酸的电离平衡常数越大,酸的酸性越强,其酸根离子的水解能力越小,结合强酸制取弱酸分析解答.
解答 解:由流程可知,加硫酸溶解只有SiO2不溶,CaO转化为微溶于水的CaSO4,趁热过滤,防止H3BO3从溶液中析出,“除杂”需先加H2O2溶液,将亚铁离子转化为铁离子,再加入MgO调节溶液的pH约为5.2,使铁离子、铝离子均转化为沉淀,则滤渣为氢氧化铝、氢氧化铁,然后蒸发浓缩、冷却结晶、过滤分离出H3BO3.
(1)发生发生:CaCO3 (粉末)+H2SO4=CaSO4+H2O+CO2↑,应分批加入H2SO4,降低反应速率,防止产生大量泡沫使物料从反应器中溢出,
故答案为:分批慢慢加入稀硫酸;
(2)增大反应物浓度、升高温度等方法都可以提高反应速率;H3BO3的溶解度随着温度升高而增大,所以为了防止温度较低时H3BO3析出而采用热过滤,
故答案为:提高反应温度;防止因温度下降时H3BO3从溶液中析出;
(3)加适量H2O2把Fe2+氧化为Fe3+,所以H2O2的作用是:H2O2+2H++2Fe2+=2Fe3++2H2O,加MgO调节PH,使Fe3+、Al3+转化为沉淀而除去,所以除去的离子有Fe3+、Fe2+、Al3+;
故答案为:Fe3+、Fe2+、Al3+;H2O2+2H++2Fe2+=2Fe3++2H2O;
(4)根据图2可知,温度越高MgSO4•H2O的溶解度越小,由于溶液的沸点随压强增大而升高,为了防止溶液沸腾,应该在较高的压强条件下加热,使MgSO4•H2O结晶析出,然后过滤,
故答案为:加压、升温结晶、过滤;
(5)25℃时0.7mol•L-1 硼酸溶液中H+的浓度:c(H+)=$\sqrt{K.c({H}_{3}B{O}_{3})}$=$\sqrt{5.7×1{0}^{-10}×0.7}$mol/L≈2×10-5mol•L-1,故答案为:2×10-5mol•L-1;
(6)酸的电离平衡常数HF>H2CO3>H3BO3>HCO3-,所以离子水解能力:CO32->[B(OH)4]->HCO3->F-,
A.酸性HF>H2CO3>H3BO3>HCO3-,所以碳酸钠溶液滴入硼酸中生成碳酸氢钠和硼酸钠,没有气体生成,故A错误;
B.酸性HF>H2CO3>H3BO3>HCO3-,所以碳酸钠溶液滴入HF生成NaF、水和二氧化碳,所以能看到有气泡生成,故B正确;
C.等浓度的碳酸和硼酸,碳酸电离程度大于硼酸,所以碳酸中氢离子浓度大于硼酸,则pH:碳酸小于硼酸,故C错误;
D.等浓度的碳酸钠和氟化钠,碳酸根离子水解程度大于氟离子,所以相同浓度的碳酸钠溶液和氟化钠溶液的pH:前者>后者,故D正确;
故选BD.
点评 本题考查物质制备,为高频考点,涉及化学工艺流程分析、物质分离提纯、弱电解质的电离和盐类水解等知识点,明确流程图中发生的反应、弱酸电离平衡常数与其对应的酸根离子水解程度关系是解本题关键,注意(6)题中H2CO3对应是酸根离子是HCO3-而不是CO32-,为易错点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
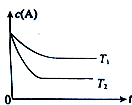 运用所学知识,解决下列问题:
运用所学知识,解决下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A是固体,C是气体,正反应吸热 | B. | A是气体,C是气体,正反应放热 | ||
| C. | A是气体,C是固体,正反应放热 | D. | A是气体,C是气体,正反应吸热 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
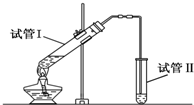 实验室用如图所示装置制备少量乙酸乙 酯.
实验室用如图所示装置制备少量乙酸乙 酯.
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
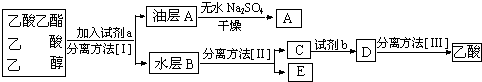
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤时,不可将悬浊液从烧杯中直接倒入漏斗中 | |
| B. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| C. | 分液操作时,现将分液漏斗中下层液体从下口放出,再将上层液体从下口放出 | |
| D. | 只要是液体混合物就可以用蒸馏来分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②④⑥ | C. | ①②⑥ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该装置中Cu极为正极 | |
| B. | 当铜极的质量变化为32 g时,a极上消耗的O2在标准状况下的体积为5.6 L | |
| C. | b极反应的电极反应式为H2-2e-+2OH-═2H2O | |
| D. | 一段时间后锌片一极质量增加 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com