
【题目】实验室制备1,2-溴乙烷的反应原理如下:CH3CH2OH![]() CH2=CH2+H2O CH2=CH2+Br2
CH2=CH2+H2O CH2=CH2+Br2![]() BrCH2CH2Br可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚。用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
BrCH2CH2Br可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚。用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
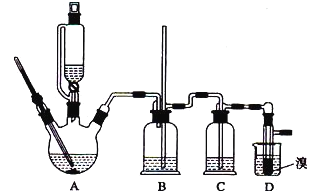
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度(g/cm3) | 0.79 | 2.2 | 0.71 |
沸点(℃) | 78.5 | 132 | 34.6 |
熔点(℃) | -130 | 9 | -116 |
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是______(填正确选项前的字母)。
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)装置B的作用是______。
(3)在装置c中应加入____(填正确选项前的字母),其目的是吸收反应中可能生成的酸性气体。
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)判断该制备反应己经结束的最简单方法是_______。
(5)将1, 2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在____层(填“上”、“下”)。
(6)若产物中有少量未反应的Br2,最好用______(填正确选项前的字母)洗涤除去。
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(7)若产物中有少量副产物乙醚,可用________的方法除去。
(8)反应过程中应用冷水冷却装置D,其主要目的是_________;但又不过度冷却(如用冰水),其原因是______________________。
【答案】d 安全瓶的作用 c 溴的颜色完全褪去 下 b 蒸馏 乙烯与溴反应时放热,冷却可避免溴的大量挥发 1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞
【解析】
(1)乙醇在浓硫酸作用下加热到140℃发生分子间脱水生成乙醚;
(2)当装置发生堵塞时,B装置中液体会压入长玻璃导管,甚至溢出导管,以观测和缓解气压增大;
(3)浓硫酸具有脱水性、强氧化性,乙醇与浓硫酸反应的副产物有SO2和CO2;
(4)乙烯和溴水发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷为无色液体;
(5)根据1,2-二溴乙烷和水的密度相对大小解答;
(6)Br2易与碱溶液反应生成盐和水;
(7)乙醚和1,2-溴乙烷是互溶液体;
(8)溴易挥发,冷却防止溴大量挥发;1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞;
(1)乙醇在浓硫酸140℃的条件下,发生分子内脱水,生成乙醚,到170℃左右才能生成乙烯,故选d;
(2)当装置发生堵塞时,B装置中液体会压入长玻璃导管,甚至溢出导管,以观测和缓解气压增大,所以装置B起安全瓶的作用;
(3)装置C吸收乙醇与浓硫酸反应的副产物有SO2和CO2,装置c中应加入氢氧化钠溶液,选c;
(4)乙烯和溴水发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷为无色液体,判断该制备反应己经结束的方法是溴的颜色完全褪去;
(5)1,2-二溴乙烷的密度大于水,所以粗1,2-二溴乙烷应在下层;
(6)Br2易与碱溶液反应生成盐和水,若产物中有少量未反应的Br2,最好用氢氧化钠溶液洗涤除去,选b;
(7)乙醚和1,2-溴乙烷是互溶液体,根据沸点不同,可用蒸馏的方法除去1,2-溴乙烷中的乙醚;
(8). 乙烯与溴反应时放热,冷却可避免溴的大量挥发,所以反应过程中应用冷水冷却装置D;1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞,所以D装置不过度冷却。


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是( )
选项 | 操作 | 目的 |
A | 用酚酞作指示剂,用标准的c mol·L-1盐酸滴定一定体积未知浓度的 | 测定 |
B | 将一定量 | 配制一定物质的量浓度的 |
C | 给含碎瓷片的石蜡油加强热,并将气体通入酸性高锰酸钾溶液中 | 证明气体产物含碳碳双键 |
D | 在 | 证明 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制取ClO2的化学反应:2NaClO3+SO2+H2SO4![]() 2ClO2+2NaHSO4,下列说法中正确的是
2ClO2+2NaHSO4,下列说法中正确的是
A. NaClO3在反应中失去电子
B. SO2在反应中被氧化
C. H2SO4在反应中作氧化剂
D. 1 mol氧化剂在反应中得到2 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍与第VA族元素形成的化合物是重要的半导体材料,其中应用最广泛的是砷化镓(GaAs)。回答下列问题:
(1)基态N原子的核外电子排布式为___________,基态Ga原子核外有___________个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为___________和+3。砷的电负性比镓___________(填“大”或“小”)。
(3)二水合草酸镓的结构如图所示,其中镓原子的配位数为___________。

(4)砷化镓可由(CH3)3Ga和AsH3在700℃时制得。(CH3)3Ga中镓原子的杂化方式为___________。
(5)GaAs为原子晶体,密度为ρg·cm-3,其晶胞结构如图所示。Ga与As以___________键键合。Ga和As的原子半径分别为apm和bpm,设阿伏加德罗常数的值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为___________(列出计算式,可不化简)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.金属钠着火时,可用泡沫灭火器灭火
B.常温下,Al、Fe遇浓硫酸或浓硝酸发生钝化
C.蔗糖与银氨溶液在水浴加热条件下可发生银镜反应
D.电解精炼铜过程中,若阳极质量减少32g,则电路中转移电子数目为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将气体A、B置于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)![]() 2C(g)+2D(g),反应进行到10 s末,达到平衡,测得A的物质的量为1.8 mol,B的物质的量为0.6 mol,C的物质的量为0.8 mol。
2C(g)+2D(g),反应进行到10 s末,达到平衡,测得A的物质的量为1.8 mol,B的物质的量为0.6 mol,C的物质的量为0.8 mol。
(1)用C表示10 s内反应的平均反应速率为________。
(2)反应前A的物质的量浓度是________。
(3)10 s末,生成物D的浓度为________。
(4)A与B的平衡转化率之比为________。
(5)平衡后,若改变下列条件,生成D的速率如何变化(填“增大”、“减小”或“不变”):
①降低温度____________;②增大A的浓度____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
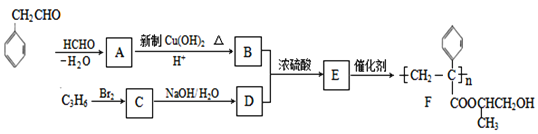
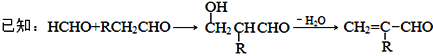
【题目】聚合物F的合成路线图如下:
请据此回答:
(1)A中含氧官能团名称是_______,C的系统命名为_________。
(2)检验B中所含官能团所用的试剂有______;E→F的反应类型是___________。
(3)C生成D的反应化学方程式为_____________________________,如果C与NaOH的醇溶液反应,则生成的有机物的结构简式为________(同一个碳原子上连两个碳碳双键的除外)。
(4)G物质与![]() 互为同系物,且G物质的相对分子质量比
互为同系物,且G物质的相对分子质量比![]() 大14的,则符合下列条件的G的同分异构体有____种。
大14的,则符合下列条件的G的同分异构体有____种。
① 分子中含有苯环,且苯环上有两个取代基 ② 遇氯化铁溶液变紫色
③ 能与溴水发生加成反应
(5) 参照上述合成路线,设计一条由甲醛、乙醛和甲醇为主要原料制备 ![]() 的合成路线__________________。
的合成路线__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一定温度和压强下,1体积X2(g)和3体积Y2(g)化合生成2体积Z(g),则Z气体的化学式是___。
(2)A、B两种气体组成的混合气体8.6g,在标准状况下体积为8.96L。已知A与B的物质的量之比为3:1,相对分子质量之比为14:1,由此可推断A可能是__或__,B是__。
(3)在标准状况下,CO和CO2的混合气体质量为36g,体积为22.4L,则CO所占的体积是___L,质量是___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学”是21世纪化学发展的主导方向。“绿色化学”要求从根本上消除污染,是一门能防止污染的科学。它包括“原料的绿色化”“化学反应的绿色化”“产物的绿色化”等内容。其中“化学反应的绿色化”要求反应物中所有的原子完全被利用且全部转入期望的产品中。下列不符合“化学反应的绿色化”的是( )
A.制![]() :
:![]()
B.制![]() :
:![]()
C.制![]() :
: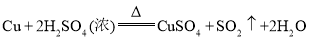
D.制聚乙烯:nCH2=CH2![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com