
| A. | 向AgNO3溶液中加入Cu粉:Cu+2Ag+═Cu2++2Ag | |
| B. | 向CaCl2溶液中通入CO2:Ca2++CO2+H2O═CaCO3↓+2H+ | |
| C. | 饱和FeCl3溶液滴入沸水中制Fe(OH)3胶体:Fe3++3H2O═Fe(OH)3↓+3H+ | |
| D. | CuSO4溶液与Ba(OH)2溶液混合:Ba2++SO42-═BaSO4↓ |
分析 A.二者反应生成硝酸铜和银;
B.盐酸的酸性强于碳酸,依据强酸制备弱酸的规律解答;
C.氢氧化铁胶体不是沉淀;
D.漏掉铜离子与氢氧根离子的反应.
解答 解:A.向AgNO3溶液中加入Cu粉,离子方程式:Cu+2Ag+═Cu2++2Ag,故A正确;
B.盐酸的酸性强于碳酸,依据强酸制备弱酸向CaCl2溶液中通入CO2不发生反应,故B错误;
C.饱和FeCl3溶液滴入沸水中制Fe(OH)3胶体,离子方程式:Fe3++3H2O?Fe(OH)3(胶体)+3H+,故C错误;
D.CuSO4溶液与Ba(OH)2溶液混合,离子方程式:Cu2++2OH-+Ba2++SO42-═BaSO4↓+Cu(OH)2↓,故D错误;
故选:A.
点评 本题考查了离子方程式的书写,侧重考查复分解反应的离子方程式,明确反应实质是解题关键,注意化学式的拆分,注意离子反应遵循客观事实,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,2.8 g N2和CO的混合气体所含原子数为0.2 NA | |
| B. | 1 mol Cl2与足量Fe完全反应,转移3NA个电子 | |
| C. | 1 L 0.1 mol•L-1NaHCO3溶液中含有0.1 NA个HCO3- | |
| D. | 常温常压下,22.4L乙烯中C-H键数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 如图为A、B、C三种物质的溶解度曲线,据图回答下列问题:
如图为A、B、C三种物质的溶解度曲线,据图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 硝酸越稀还原产物中氮元素的化合价越低.某同学取铁铝合金与足量很稀的硝酸充分反应没有气体放出.在反应后的溶液中逐滴加入4mol•L-1 NaOH溶液,所加NaOH溶液的体积与产生的沉淀的物质的量的关系如图.下列说法不正确的是( )
硝酸越稀还原产物中氮元素的化合价越低.某同学取铁铝合金与足量很稀的硝酸充分反应没有气体放出.在反应后的溶液中逐滴加入4mol•L-1 NaOH溶液,所加NaOH溶液的体积与产生的沉淀的物质的量的关系如图.下列说法不正确的是( )| A. | D点溶液中存在:c(NH4+)+c(Na+)+c(H+)=c(OH-)+c(NO3-) | |
| B. | EF段发生化学反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O | |
| C. | 原溶液中n(NH4+)=0.012mol | |
| D. | 溶液中结合OH-能力最强的离子是H+,最弱的离子是Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
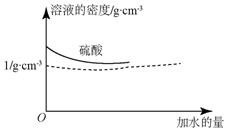 已知硫酸的密度与所加水量的关系如图所示,
已知硫酸的密度与所加水量的关系如图所示,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠溶液呈碱性,可用热的纯碱溶液除去矿物油污 | |
| B. | 氧化铝的熔点很高,可用于制作耐高温材料 | |
| C. | C12、SO2均有漂白性,可使紫色石蕊溶液褪色 | |
| D. | 钠的金属性强于钾,工业上可用钠制取钾Na+KCl$\frac{\underline{\;850℃\;}}{\;}$K↑+NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
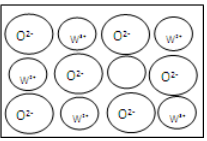 X、Y、Z、W四种元素原子序数依次增大且均小于36.Z基态原子最外层电子数是其内层电子总数的3倍,Y基态原子是同周期元素中未成对电子数最多的原子,X分别与Y、Z元素组合均可形成10电子微粒,W基态原子有10个价电子. 回答下列问题(以下问题均以推知元素符号作答):
X、Y、Z、W四种元素原子序数依次增大且均小于36.Z基态原子最外层电子数是其内层电子总数的3倍,Y基态原子是同周期元素中未成对电子数最多的原子,X分别与Y、Z元素组合均可形成10电子微粒,W基态原子有10个价电子. 回答下列问题(以下问题均以推知元素符号作答):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 松油醇的结构简式为 ,则其同分异构体可能属于醛类、酮类或芳醇类 ,则其同分异构体可能属于醛类、酮类或芳醇类 | |
| B. | 甲烷和氯气的反应与乙烯和Br2的反应属于同一类型的反应 | |
| C. | 分子式为C4H8O2且能与氢氧化钠溶液反应的有机物(不考虑立体异构和醛类物质)有6种 | |
| D. | 乙醇、乙酸均能与NaOH溶液反应,因为分子中均含有-OH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com